El control de la tuberculosis exige nuevas pautas terapéuticas que superen las actuales, disponibles desde hace más de 30 años. En virtud de un acuerdo, siete centros de la Unitat d'Investigació en Tuberculosi de Barcelona (UITB) vienen colaborando con la División para la Eliminación de la Tuberculosis de los Centers for Disease Control de Estados Unidos en el desarrollo de diversos ensayos clínicos en el tratamiento de la infección y la enfermedad tuberculosa. La colaboración se inició en 2004 con el Estudio 26, que compara la eficacia y la tolerabilidad de rifapentina + isoniazida administradas una vez por semana durante tres meses frente a la pauta estándar, para la forma latente. Incluimos 246 sujetos (3% del total). En febrero de 2008 se cerró la inclusión general. El estudio permanece abierto para sujetos VIH positivos y niños. Tratar con 12 dosis y no con 270 (terapia estándar) supondrá un éxito evidente. Habrá que esperar, sin embargo, hasta 2010 para conocer el análisis. El Estudio 28 (iniciado en 2006) comparó, para el tratamiento de la tuberculosis pulmonar, la pauta estándar con una experimental en la cual la isoniazida se sustituyó por moxifloxacino. La UITB incluyó 15 pacientes (3,5% del total). Los resultados provisionales (presentados en la 47o Interscience Conference on Antimicrobial Agents and Chemotherapy de Chicago de 2007) no mostraron diferencias entre las dos pautas en la conversión del esputo a las 8 semanas de tratamiento. Recientemente hemos comenzado el Estudio 29, en el cual la rifapentina sustituye a la rifampicina en la pauta estándar de tratamiento.
New treatment guidelines are required to improve the tuberculosis control strategies that have been used for 30 years. Seven centers of the Barcelona Tuberculosis Research Unit (BTRU) (Unitat d'Investigació en Tuberculosi de Barcelona) are collaborating with the Division of Tuberculosis Elimination of the United States Centers for Disease Control and Prevention in a series of clinical trials on latent tuberculosis infection and tuberculosis disease. BTRU participation began in 2004 with Study 26, an evaluation of the efficacy and tolerability of rifapentine plus isoniazid administered once weekly for 3 months compared with the standard treatment for latent tuberculosis infection. The BTRU centers together enrolled 246 patients (3% of the total). General enrollment was completed in February, 2008. HIV-infected patient and child enrollment continues. Treatment with 12 doses instead of 270 doses is expected to be a clear success. However, the analysis will be completed in 2010. Study 28 (started in 2006), designed for the treatment of pulmonary tuberculosis, compared standard treatment with an experimental regimen substituting moxifloxacin for isoniazid. BTRU centers together enrolled 15 patients (3.5% of the total). The provisional results (presented at the 47th Interscience Conference on Antimicrobial Agents and Chemotherapy in Chicago, 2007) showed no difference between the sputum conversion rate of each regimen at week 8 of treatment. Study 29 is currently underway, in which rifapentine was introduced in the experimental regimen for active tuberculosis treatment.
El incremento de las resistencias y la persistencia de la endemia tuberculosa (según estimaciones de la Organización Mundial de la Salud, en 2007 hubo 9,2 millones de nuevos casos y cerca de 1,7 millones de personas fallecidas por tuberculosis)1 aconsejan continuar con la búsqueda de nuevos fármacos que mejoren los tratamientos existentes, venzan las resistencias y logren pautas que, siendo efectivas, nos permitan acortar la duración del tratamiento, favorezcan su adecuado cumplimiento y, en consecuencia, faciliten el control de la enfermedad.
Dadas las características epidemiológicas de la tuberculosis, resulta fundamental establecer unos circuitos de colaboración entre los países desarrollados y aquéllos más pobres y con cargas de tuberculosis más elevadas2, así como ajustar los diseños de estos circuitos para obtener la mayor rentabilidad3,4. En este sentido, en los últimos años diversos organismos públicos y privados se vienen implicando en el desarrollo de ensayos clínicos conjuntos que permitan, por un lado, ayudar al control y al tratamiento desde los países pobres, y por otro a establecer los mecanismos para que los procedimientos sean homogéneos y permitan valorar de forma uniforme los resultados obtenidos en diversos puntos del planeta para hacer más rentables y efectivos los diversos estudios5,6.
El objetivo de este artículo es dar a conocer nuestro trabajo con el Tuberculosis Trials Consortium (TBTC) de los Centers for Disease Control and Prevention (CDC) en el campo de la investigación de nuevos tratamientos en tuberculosis.
UITB/TBTCLa Unitat d'Investigació en Tuberculosi de Barcelona (UITB) es un grupo de estudio multicéntrico y multidisciplinario, compuesto por médicos clínicos, personal de enfermería, de farmacia, microbiólogos, epidemiólogos y agentes sociales que desarrollan su labor profesional en hospitales, centros de atención primaria y especializada, y también en establecimientos penitenciarios. Es una unidad flexible, estructurada en diferentes grupos de trabajo que se articulan en torno a variados proyectos de investigación orientados a ofrecer información microbiológica, clínico-epidemiológica y antropológica que facilite la mejora del control y la prevención de la tuberculosis en el mismo entorno en que se desarrolla su intervención. Es decir, generar evidencia científica de calidad que permita diseñar estrategias de control y prevención más eficaces y aplicables en cualquier ámbito de actuación y por cualquier programa.
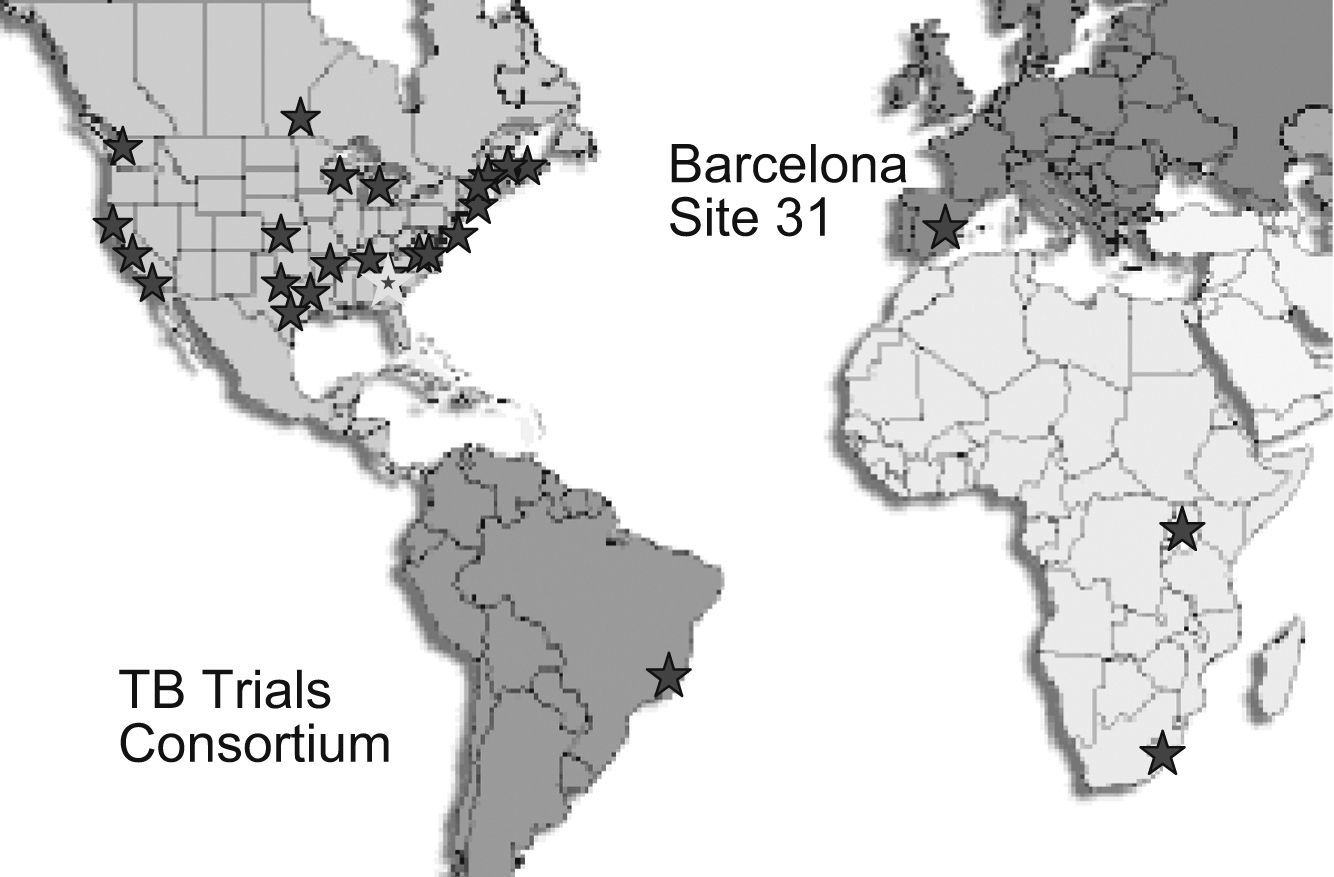
En virtud de un acuerdo con el University of North Texas Health Sciences Center, firmado en septiembre de 2003, seis de los centros que participan en la UITB colaboran con la sección de ensayos clínicos de la División para la Eliminación de la Tuberculosis de los CDC (el Tuberculosis Trials Consortium, TBTC). Este grupo constituye el Site 31 del TBTC y está coordinado conjuntamente por el Servicio de Epidemiología de la Agència de Salut Pública de Barcelona y el Servicio de Enfermedades Infecciosas del Hospital Clínic de Barcelona. De los seis centros del Site 31, cinco son hospitales (Clínic, Vall d'Hebron, Sant Pau, Hospital del Mar y Hospital Mutua de Terrassa) y el sexto (Centre de Prevenció i Control de la Tuberculosi de Drassanes - Centre de Malalties del Tòrax) es un centro ambulatorio especializado, situado en una de las zonas socialmente más desfavorecidas y con mayores tasas de tuberculosis de la ciudad. Recientemente se ha incorporado al grupo el Hospital de Bellvitge, que atiende a una población con una tasa de tuberculosis algo superior a la de la ciudad de Barcelona.
El TBTC cuenta con más de 25 sites, la mayoría de ellos en Estados Unidos. En Canadá hay dos, y en Brasil, España, Uganda y Sudáfrica, uno en cada país. Hasta ahora, en el continente europeo, la UITB es el único grupo colaborador con el TBTC (fig. 1).
Estudio 26Los ensayos clínicos patrocinados por el TBTC son la continuación de una serie de 21 estudios sobre tuberculosis promovidos por el Servicio de Salud Pública de Estados Unidos (USPHS). Estas investigaciones van desde la aplicación clínica de la estreptomicina en el tratamiento de la tuberculosis, a finales de los años 1950, hasta la identificación del VIH como el agente causal de la epidemia de sida en la década de 1980. La trayectoria paralela y ascendente de ambas enfermedades, sida y tuberculosis, durante más de diez años es, en parte, la causa de que los ensayos clínicos en tuberculosis dependan de la División para la Eliminación de la Tuberculosis de los CDC.
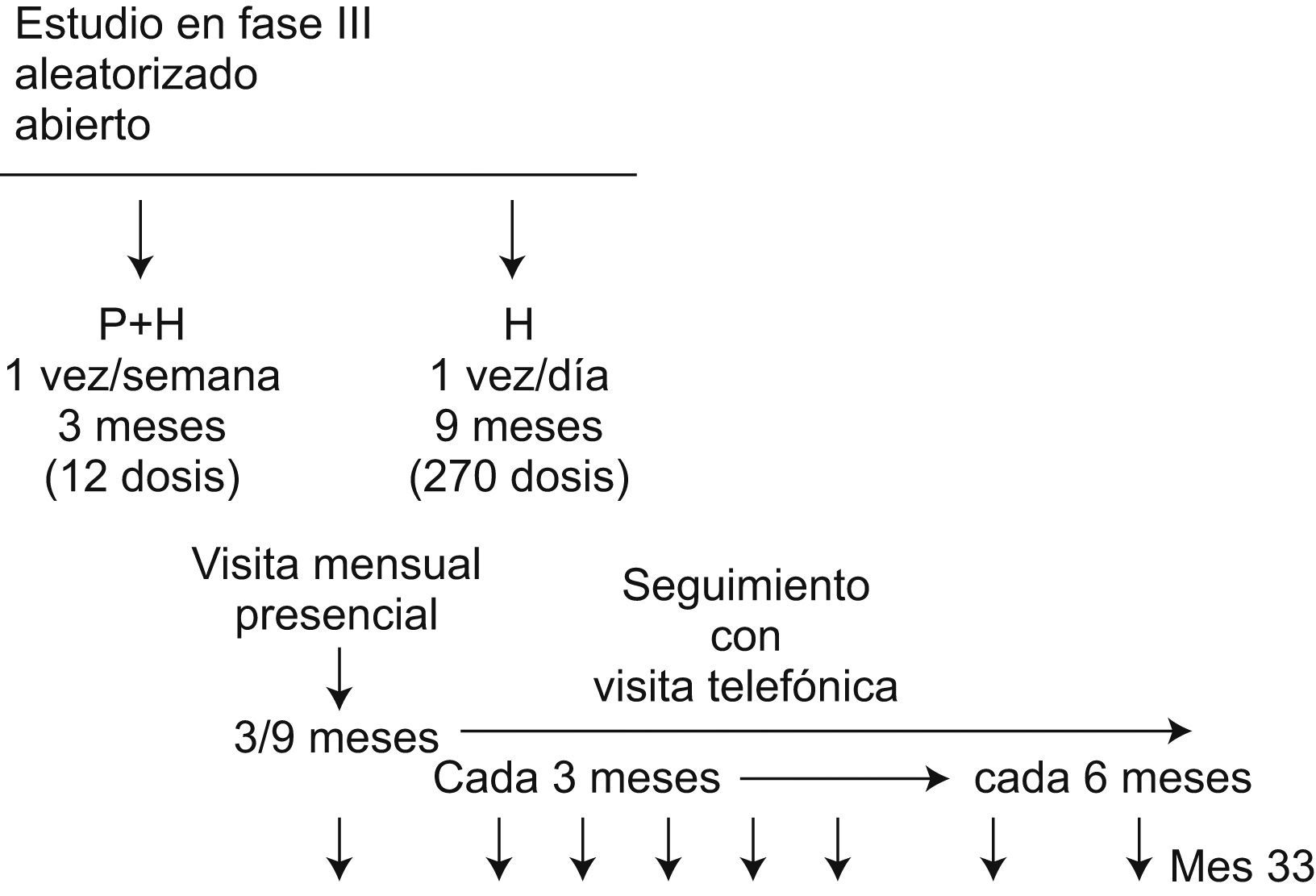
El primer ensayo clínico del TBTC con participación de la UITB es el llamado Estudio 26, cuyo objetivo es comparar la eficacia y la tolerabilidad de la asociación de rifapentina (una rifamicina de vida media larga)7 con isoniazida, ambas administradas como tratamiento directamente observado una vez a la semana durante 3 meses (3PH, pauta experimental), frente a isoniazida sola, tomada diariamente por el paciente sin supervisión durante 9 meses (9H, pauta recomendada por la American Thoracic Society)8 para el tratamiento de la infección tuberculosa latente.
La asignación a cada una de las pautas se realiza mediante un programa informático y es aleatoria. La dosis de isoniazida es de 5mg/kg/día en la pauta control (9H) y de 15mg/kg/semana en la pauta experimental (3PH). Como en el caso de la isoniazida, la dosis de rifapentina se ajusta al peso del paciente (900mg/semana para un peso>50kg y 750mg/semana para un peso #<50kg). La administración de la pauta experimental se realiza en régimen directamente observado, mientras que en la pauta control es autoadministrada. Las dosis ingeridas se registran semanalmente en el caso de 3PH y mensualmente para 9H. La medida de eficacia es la incidencia de tuberculosis durante un período de seguimiento de 33 meses desde el ingreso en el estudio. Respecto a la tolerabilidad y la seguridad, se evalúan el abandono permanente del protocolo debido a reacciones adversas a la medicación, el desarrollo de toxicidad de grados 3 y 4 (según la escala de criterios comunes de toxicidad del National Cancer Institute de Estados Unidos, versión 2.0, abril 1999) y la muerte (fig. 2).
El número de sujetos requeridos para responder al objetivo del estudio fue fijado en 8000, 4000 para cada una de las ramas. Podían ser incluidas en el estudio todas aquellas personas con al menos uno de los siguientes factores de riesgo para desarrollar tuberculosis: 1) contactos estrechos de pacientes con tuberculosis pulmonar bacilífera, 2) coinfectados por Mycobacterium tuberculosis y VIH, 3) conversores recientes de la prueba de tuberculina (entendiendo como tales aquellos en que haya transcurrido un tiempo máximo de 2 años entre una prueba negativa previa y otra positiva, en el momento de la inclusión en el estudio), y 4) lesiones radiológicas sospechosas de ser de origen tuberculoso, si nunca han recibido tratamiento específico y una vez descartada, con tres muestras de esputo seriadas negativas, la presencia de tuberculosis activa. Fueron criterios de exclusión: 1) tuberculosis activa (sospechada o demostrada microbiológicamente), 2) alteración de la biología hepática, definida por cifras basales de transaminasas mayores de tres veces el límite superior de la normalidad, 3) tratamiento previo con rifamicinas durante más de 14 días consecutivos o con isoniazida durante más de 30 días consecutivos en los 2 años previos a la inclusión en el estudio, y 4) infección por el VIH en tratamiento (concomitante o previsto) con fármacos con conocida interacción con las rifamicinas durante los 3 meses iniciales del estudio.
La participación en el estudio es voluntaria y se exige la firma de un consentimiento informado antes de proceder a la aleatorización y a cualquier procedimiento del ensayo.
Nuestro grupo incluyó el primer paciente en el mes de febrero de 2004 (cuando ya se habían incluido 2500 sujetos en todo el mundo y un año después del inicio del estudio). Hasta febrero de 2008, fecha en que se alcanzaron los 8000 pacientes previstos, contribuimos con la inclusión de algo más del 3% del total de los sujetos incluidos. La necesidad de disponer de datos farmacocinéticos sólidos sobre la rifapentina en los niños, la baja incidencia de tuberculosis entre los individuos incluidos hasta el momento y el bajo número de sujetos infectados por el VIH incluidos han hecho que se presente una enmienda que permita incrementar el número de personas infectadas con mayor riesgo de desarrollar tuberculosis: los niños menores de 12 años y los coinfectados por el VIH. Se prevé que los resultados finales se conocerán en 2010.
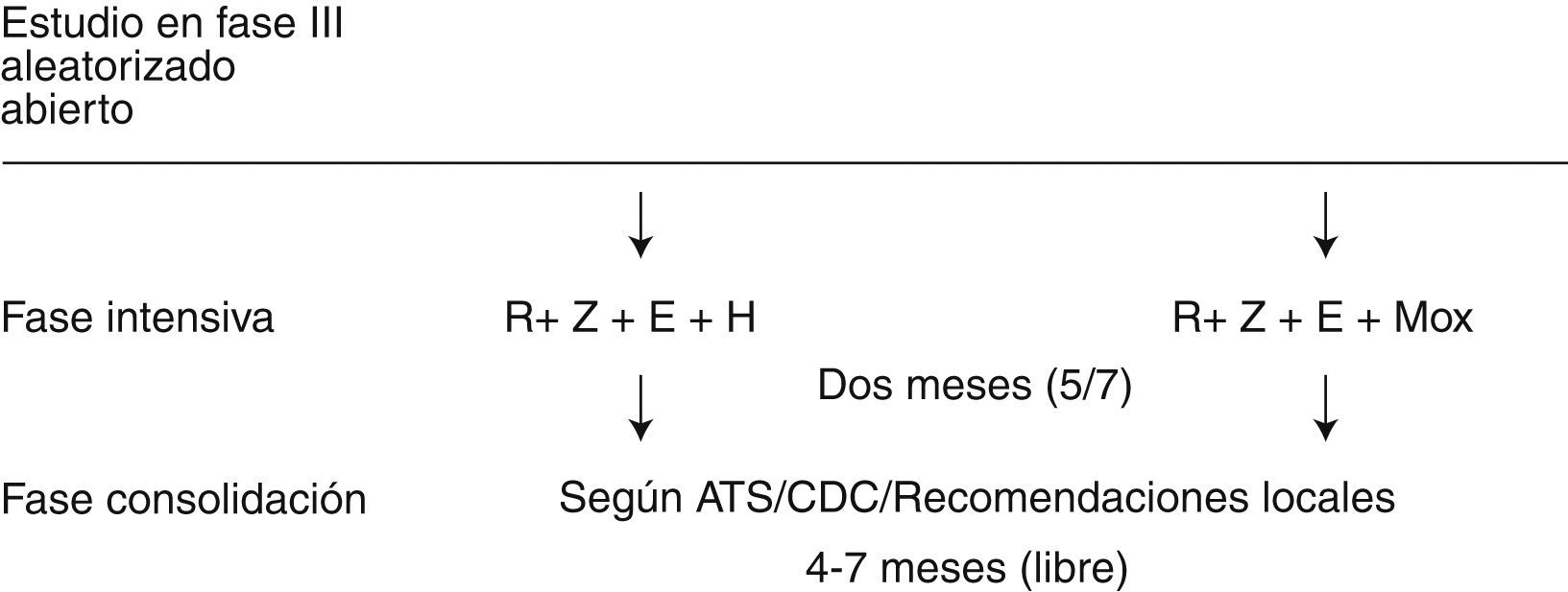
Estudio 28El segundo ensayo clínico del TBTC en que ha participado la UITB es el Estudio 28, cuyo objetivo, atendiendo a los resultados del perfil bactericida del moxifloxacino en el modelo múrido9, era demostrar que la pauta antituberculosa recomendada por la American Thoracic Society (ATS), que asocia isoniazida, rifampicina, pirazinamida y etambutol (2HRZE) durante los 2 meses iniciales del tratamiento podía ser mejorada por una pauta experimental, basada en sustituir la isoniazida por moxifloxacino (2MRZE). De confirmarse dicha hipótesis, podría plantearse que un tratamiento intensivo de mayor efectividad podría completarse con un periodo de tratamiento de continuación acortado, reduciéndose así la duración total del tratamiento de 6 o más meses a menos de 4, con las consecuentes ventajas sobre el cumplimiento del tratamiento y el control de la enfermedad.
Como en el Estudio 26, las dosis de los fármacos utilizados, excepto moxifloxacino, que se administró a dosis fija de 400mg, se ajustaron según el peso. La asignación de la pauta fue aleatoria y la administración de todo el tratamiento durante la fase de estudio fue directamente observado y doble-ciego, enmascarado con placebo. La medida de eficacia fue la tasa de negativización del cultivo de esputo por rama de tratamiento entre los pacientes que lo habían recibido de forma correcta: al menos 40 dosis en 8 semanas. Los resultados se compararon atendiendo a la presencia o ausencia de cavitación en la radiografía de tórax en la visita basal, y al lugar de inclusión de los pacientes: África frente a no África. El tratamiento se completó mediante una fase de continuación hasta los 6 meses de duración total, o bien 9 meses (en caso de cavitación en la radiografía de tórax basal y de un cultivo de esputo positivo para M. tuberculosis al final de las 8 semanas de la fase intensiva).
Las pautas empleadas en la segunda fase del tratamiento fueron libres, siguiendo las recomendaciones de los CDC o de las sociedades científicas locales (American Thoracic Society, Grupo de Trabajo sobre Tuberculosis)10,11. Se realizó una supervisión específica de la toxicidad sobre el nervio óptico por ser un conocido efecto secundario del etambutol y por haberse observado también en algunos animales tras un tratamiento prolongado con moxifloxacino. Se practicaron pruebas de agudeza visual y de visión del color. Se realizaron controles analíticos seriados de sangre (hemograma, AST, bilirrubina sérica total y creatinina plasmática). También se evaluó el desarrollo de toxicidad de grados 3 y 4 (según la escala de criterios comunes de toxicidad del Nacional Cancer Institute de Estados Unidos, versión 2.0, abril 1999) y la muerte (fig. 3).
Para ser incluidos en el estudio, los pacientes debían tener sospecha clínica y radiología compatible con tuberculosis pulmonar, una tinción de esputo positiva para bacilos ácido-alcohol resistentes y haber accedido a realizarse una serología frente al VIH, si no disponían de ninguna determinación en el año previo. No se incluyeron pacientes con valores de transaminasas superiores a tres veces el límite superior de la normalidad en el análisis basal, que hubieran recibido más de 7 días de tratamiento antituberculoso en los 6 meses previos a la inclusión o tratamiento con una quinolona durante más de 7 días en los 3 meses previos a la inclusión. Tampoco se incluyeron mujeres embarazadas ni niños, ni pacientes coinfectados por el VIH en tratamiento antirretroviral o pendientes de iniciarlo durante la fase intensiva. Tampoco se incluyeron pacientes con sospecha de tuberculosis miliar o del sistema nervioso central. Se excluyeron del estudio los pacientes en que no se confirmó la presencia de M. tuberculosis en el cultivo y aquellos en que se aisló una cepa resistente a alguno de los fármacos del estudio. Como en el Estudio 26, la participación fue voluntaria y se requirió la firma del consentimiento informado antes del inicio de los procedimientos del estudio. La duración del periodo de inclusión fue de 12 meses, de febrero de 2006 a febrero de 2007, durante los cuales se incluyeron 433 pacientes, contribuyendo la UITB con 15 (3,5%).
Los primeros resultados del Estudio 28, presentados en la 47o Interscience Conference on Antimicrobial Agents and Chemotherapy (ICAAC) celebrada en septiembre de 2007 en Chicago12, no confirmaron la superioridad de la pauta experimental para conseguir la negativización del esputo antes de la octava semana de tratamiento (final de la fase intensiva/fase de estudio). Analizando de forma univariada y multivariada los estratos que incluían a los pacientes africanos y no africanos, y a los pacientes con radiografía cavitada y no cavitada, se observó que tanto los incluidos en África como los que presentaban cavitaciones tuvieron menores tasas de negativización del esputo en la octava semana de tratamiento, por lo que la cavitación en la radiografía de tórax y el haber sido reclutado en un centro en África (el 56% de los pacientes) se relacionaron de forma significativa con la persistencia de un cultivo de esputo positivo al final de la fase intensiva. Por otro lado, el medio de cultivo líquido en los pacientes africanos mostró mayor rentabilidad que en los procedentes de Europa o América. Dicho de otro modo: la recuperación de micobacterias en medio de cultivo sólido fue significativamente menor en comparación con los medios de cultivo líquidos en los pacientes en los centros africanos, pero esta diferencia no fue tan pronunciada en el resto de los centros. Investigaciones preliminares no indican problemas técnicos en los laboratorios, y se apunta la posibilidad de que la diferencia observada en África pudiera relacionarse con diversos factores (gravedad de la enfermedad, presencia de enfermedades concomitantes…). Estas diferencias podrían aconsejar extender la realización de este tipo de estudios a otras regiones del mundo, como Europa del Este o el Sudeste Asiático.
Los datos de seguridad y tolerabilidad no mostraron, en las condiciones de este ensayo clínico, mayor toxicidad de la pauta que contenía moxifloxacino respecto a la que contenía isoniazida.
Estudio 29Recientemente hemos iniciado nuestra participación en el Estudio 29, «Evaluación de rifapentina durante la fase intensiva de tratamiento de la tuberculosis pulmonar». Este estudio de fase II, como el Estudio 28, está orientado hacia la búsqueda de una combinación antimicobacteriana que permita acortar o simplificar (o ambas cosas) el tratamiento de la tuberculosis pulmonar. El Estudio 29 compara la pauta estándar con una pauta experimental en la cual se ha sustituido la rifampicina por rifapentina, y se fundamenta en el intenso efecto micobactericida de las rifamicinas, la mayor actividad intrínseca de la rifapentina en el modelo múrido13 y el buen perfil de seguridad de estos fármacos (excepto en los pacientes alérgicos, son muy poco tóxicos), que son bien tolerados incluso cuando se administran a dosis elevadas14. Esta circunstancia es especialmente relevante para la rifapentina, una rifamicina de vida media larga, diseñada para ser administrada en dosis semanales que, en el Estudio 29, se convierten en diarias. En estos momentos estamos en la fase de inclusión y confiamos completarla en los próximos meses.
Análisis y comentariosEn los inicios del siglo xxi, la tuberculosis sigue siendo una enfermedad de alta prevalencia a escala mundial, sobre todo en los países del «tercer mundo» y en las bolsas de pobreza de las grandes ciudades de los países desarrollados («cuarto mundo»), de difícil control y que en 2007 fue la primera causa de diagnóstico de sida en España (cerca del 30%)15. Otros factores, también observados en España, tales como la creciente aparición de cepas de M. tuberculosis resistentes a los fármacos habituales16 y los brotes epidémicos que generan alarma social17, están propiciando el desarrollo de nuevas estrategias en el tratamiento y el control de la enfermedad, y extremando los planes nacionales frente a la tuberculosis.
Cabe destacar que los trabajos que sentaron las bases de las pautas que venimos utilizando actualmente se remontan a los años 1970, y que desde entonces no ha habido avances sustanciales en este sentido. Mención especial merecen los trabajos impulsados por el British Medical Research Council inicialmente fuera de Gran Bretaña18–20 y a partir de 1997 dentro de sus fronteras. Sin embargo, también tuvieron relevancia los ensayos clínicos llevados a cabo por los CDC en Polonia21, y los que comenzaron a realizarse en Francia, Alemania y Japón, entre otros22.
No obstante, esto está comenzando a cambiar. Diversos organismos, trabajando conjuntamente con una parte de la industria farmacéutica y otros estamentos internacionales, han puesto en marcha algunos estudios encaminados a buscar alternativas que acorten y faciliten el tratamiento de la tuberculosis, y también nuevas combinaciones o fármacos efectivos ante las resistencias. Así, la Global Alliance for Tuberculosis Drug Development (TB Alliance) o los TBTC adscritos a los CDC, aglutinan esfuerzos en este sentido en diversas partes del mundo. En estos momentos hay en marcha diversos ensayos clínicos tanto de fase II y III como en investigación preclínica con nuevas moléculas23, como SQ-10924, PA-82425, TMC20726 y OPC-6768327, que presentan datos esperanzadores, e incluso estudios con nuevas vacunas terapéuticas que podrían ofrecer perspectivas diferentes para acortar los tratamientos28.
Por otra parte, la situación creada en algunos países por la tuberculosis resistente ha propiciado el uso de algunos de los fármacos utilizados para el tratamiento de otras infecciones causadas por microorganismos multirresistentes. El linezolid, por ejemplo, es uno de ellos, y pese al problema que puede suponer el manejo de sus efectos secundarios en estos pacientes29 y el elevado coste del tratamiento (un inconveniente que podría dificultar su introducción en los países pobres), se plantea como una alternativa. En este sentido, está previsto comenzar próximamente en Sudáfrica un estudio piloto con linezolid (Estudio 30), auspiciado por el TBTC y con la colaboración de Pfizer, para el tratamiento de la tuberculosis multirresistente.
Fruto de la cooperación entre países es la existencia de centros internacionales situados en Brasil, Sudáfrica, Uganda y España, que vienen colaborando con los CDC de Estados Unidos. En este sentido, cabe destacar que el de Barcelona es el único centro europeo participante hasta la actualidad.
En definitiva, los ensayos clínicos en que ha participado hasta ahora la UITB conjuntamente con los TBTC nos demostrarán en su momento que, en términos de tratamiento de la infección tuberculosa latente, una pauta que asocia una rifamicina de vida media larga a la isoniazida durante 3 meses no es inferior ni es más tóxica que la pauta propuesta por la American Thoracic Society de isoniazida durante 9 meses, con las ventajas que de ello se pueden derivar respecto al cumplimiento en régimen de tratamiento directamente observado (12 dosis).
Respecto al tratamiento de la enfermedad activa, y atendiendo al Estudio 28, el moxifloxacino podría sustituir a la isoniazida en la pauta antituberculosa estándar cuando las circunstancias (intolerancia, resistencia a la isoniazida) lo requieran, si bien no parece haber demostrado ser más eficaz para conseguir la negativización precoz del esputo (antes de 8 semanas). Este estudio también ha demostrado, de nuevo, una circunstancia ya conocida: más del 50% de los pacientes con tuberculosis pulmonar cavitada siguen teniendo cultivos positivos al final de la llamada «fase intensiva» de tratamiento, y que por alguna razón o razones desconocidas (puesto que se ajustaron variables confusoras como edad, sexo, estado serológico para el VIH y número de dosis de tratamiento antituberculoso antes de la inclusión, y se estratificó a los pacientes en función de la presencia o ausencia de cavitación) la variable «centro africano» se ha relacionado significativamente con una menor tasa de negativización del esputo detectada por cultivo en medio líquido.
Aunque este hecho podría implicar, simplemente, la existencia de pacientes con una mayor afectación, con una evolución clínica previa más prolongada antes del inicio del tratamiento del estudio y más desnutridos, debemos considerar de cara al futuro que los nuevos protocolos deberán intentar, por una parte, minimizar los problemas metodológicos relacionados con la heterogeneidad del estudio microbiológico de las muestras respiratorias en países muy diversos (técnicas de recogida y procesamiento exactamente iguales, medios de cultivo procedentes de un mismo proveedor, etc.), y por otra asociar, tal vez, un estudio farmacocinético que incluya tanto concentraciones en un momento dado como curvas completas con los fármacos experimentales, que ayuden a fijar las probables diferencias entre el modelo múrido y la cinética humana y, por tanto, a establecer las dosis y las combinaciones más eficaces in vivo para el ser humano. También, y siempre que sea posible, sería aconsejable realizar estudios genéticos y moleculares de las cepas de M. tuberculosis que nos permitan determinar si hay diferencias entre los pacientes con tuberculosis pulmonar en distintas regiones del planeta (¿o quizá entre huéspedes de diferente barrera genética?) que condicionen que la respuesta microbiológica al tratamiento pueda ser un tanto heterogénea.
El presente de la tuberculosis no es bueno y sigue siendo un problema de salud pública de primer orden, debido a factores tales como la pobreza, el VIH, las resistencias, los programas de control limitados y la inmigración masiva30. Si bien las tasas parecen decrecer, el aumento de la población mundial hace que el número absoluto de casos de tuberculosis en el mundo siga aumentando1. El futuro será más prometedor aunando esfuerzos que incrementen la investigación y la colaboración entre estamentos públicos y privados, que favorezcan la aparición y la implementación de pautas de tratamiento más cortas, más eficaces y mejor toleradas.
Grupo de trabajo de la UITB (Site 31)Fernando Alcaide Fernández de Vega (Servicio de Microbiología, Hospital Universitario de Bellvitge, L'Hospitalet, Barcelona), Neus Altet (Centro de Prevención y Control de la Tuberculosis, Barcelona), Adela Cantos (Centro de Prevención y Control de la Tuberculosis, Barcelona), Joan A. Caylà (Servicio de Epidemiología-Centro de Investigaciones Biomédicas de Epidemiología y Salud Pública en Red [CIBERESP], Agència de Salut Pública de Barcelona), Pere Coll (Servicio de Microbiología, Hospital de Sant Pau, Barcelona), Eva Cuchí (Servicio de Microbiología, Hospital Mútua de Terrassa), Vicenç Falcó (Servicio de Enfermedades Infecciosas, Hospital Universitario Vall d'Hebron, Barcelona), Laura García (Servicio de Enfermedades Infecciosas, Hospital Clínic-IDIBAPS, Universidad de Barcelona), Julià González (Servicio de Microbiología, Hospital Clínic-IDIBAPS, Universidad de Barcelona), Arkaitz Imaz (Servicio de Enfermedades Infecciosas, Hospital Universitario Vall d'Hebron, Barcelona), Lourdes Jiménez (Servicio de Enfermedades Infecciosas, Hospital Clínic-IDIBAPS, Universidad de Barcelona), Ma Ángeles Jiménez (Centro de Prevención y Control de la Tuberculosis, Barcelona), Carmen Ligero (Servicio de Enfermedades Infecciosas, Hospital Clínic-IDIBAPS, Universidad de Barcelona), José L. López-Colomés (Servicio de Medicina Interna-Enfermedades Infecciosas, Hospital del Mar, Barcelona), José Maldonado (Centro de Tratamiento Directamente Observado de la Tuberculosis, Serveis Clínic, Barcelona), María Luisa Manzanares y Nuria Martín-Casabona (Servicio de Microbiología, Hospital Universitario Vall d'Hebron, Barcelona), José A. Martínez (Servicio de Enfermedades Infecciosas, Hospital Clínic-IDIBAPS, Universidad de Barcelona), Xavier Martínez-Lacasa (Servicio de Medicina Interna-Enfermedades Infecciosas, Hospital Mútua de Terrassa, Barcelona), Teresa Mejías (Servicio de Medicina Preventiva, Hospital Clínic-IDIBAPS, Universidad de Barcelona), Celia Milà (Centro de Prevención y Control de la Tuberculosis, Barcelona), Joan Pau Millet (Servicio de Epidemiología-Centro de Investigaciones Biomédicas de Epidemiología y Salud Pública en Red [CIBERESP], Agencia de Salut Pública de Barcelona), José M. Miró (Servicio de Enfermedades Infecciosas, Hospital Clínic-IDIBAPS, Universidad de Barcelona), Israel Molina (Servicio de Enfermedades Infecciosas, Hospital Universitario Vall d'Hebron, Barcelona), Antonio Moreno (Servicio de Epidemiología-Centro de Investigaciones Biomédicas de Epidemiología y Salud Pública en Red [CIBERESP], Agència de Salut Pública de Barcelona), Laura Muñoz (Unitat Clínica de Tuberculosi, Servicio de Enfermedades Infecciosas, Hospital Universitario de Bellvitge, L'Hospitalet, Barcelona), Jeanne Nelson (Servicio de Epidemiología-Centro de Investigaciones Biomédicas de Epidemiología y Salud Pública en Red [CIBERESP], Agència de Salut Pública de Barcelona), Inmaculada Ocaña (Servicio de Enfermedades Infecciosas, Hospital Universitario Vall d'Hebron, Barcelona), Ángels Orcau (Servicio de Epidemiología-Centro de Investigaciones Biomédicas de Epidemiología y Salud Pública en Red [CIBERESP], Agència de Salut Pública de Barcelona), Mercé Poal (Servicio de Enfermedades Infecciosas, Hospital Clínic-IDIBAPS, Universidad de Barcelona), Montserrat Riera (Servicio de Medicina Interna-Enfermedades Infecciosas, Hospital Mútua de Terrassa, Barcelona), Cristina Rius (Servicio de Epidemiología-Centro de Investigaciones Biomédicas de Epidemiología y Salud Pública en Red [CIBERESP], Agència de Salut Pública de Barcelona), Ana Rodríguez y Marta Sala (Servicio de Enfermedades Infecciosas, Hospital Clínic-IDIBAPS, Universidad de Barcelona), Margarita Salvadó (Laboratorio de Microbiología, Laboratorio de Referencia de Cataluña, Barcelona), Ma Antonia Sambeat (Servicio de Medicina Interna, Unidad de Enfermedades Infecciosas, Hospital de Sant Pau, Barcelona), Francesca Sánchez (Servicio de Epidemiología-Centro de Investigaciones Biomédicas de Epidemiología y Salud Pública en Red [CIBERESP], Agència de Salut Pública de Barcelona), Miguel Santin (Unitat Clínica de Tuberculosi, Servicio de Enfermedades Infecciosas, Hospital Universitario de Bellvitge, L'Hospitalet, Barcelona), Ma Luiza de Souza (Centro de Prevención y Control de la Tuberculosis, Barcelona), Rafael Vidal (Servicio de Neumología, Hospital Universitario Vall d'Hebron, Barcelona), Ana Vilella (Servicio de Medicina Preventiva, Hospital Clínic-IDIBAPS, Universidad de Barcelona).