Conocer si la incidencia de leptospirosis en los capturadores de cangrejo rojo durante el periodo de captura es superior a la de la población general, así como identificar factores de riesgo y estimar los costes sanitarios directos e indirectos asociados a los casos de seroconversión de dicha enfermedad.
MétodoEste estudio se realizó desde el 1 de julio de 2017 hasta el 31 de marzo de 2018. Se llevó a cabo un estudio de cohortes prospectivo (población expuesta: capturadores de cangrejo rojo; población no expuesta: población general) en el municipio de Isla Mayor (Sevilla, España). Previo consentimiento informado, se invitó a la población al estudio de prevalencia mediante la técnica cualitativa ELISA. Los que tuvieron serología negativa fueron incluidos en el estudio de cohortes. Ambas cohortes se siguieron clínicamente y a los casos sintomáticos se les realizó serología. A los capturadores de cangrejo rojo se les tomó una segunda muestra de suero al final del seguimiento para detectar asintomáticos. La serovariedad se confirmó mediante aglutinación microscópica. Se realizó un análisis descriptivo bivariado y se calcularon la incidencia acumulada y el riesgo relativo. La serología positiva se tomó como variable dependiente.
ResultadosSe incluyeron en el estudio 278 personas, de las que 92 constituían la cohorte de capturadores y 186 la de población general. El 46,8% de la muestra eran mujeres, aunque entre los capturadores de cangrejo rojo estas solo representaban el 29,3%. La edad media de la muestra fue de 45,1 (± 16,4) años. Se detectaron nueve seroconversiones: ocho en capturadores de cangrejo rojo y una en población general. Por lo tanto, la incidencia acumulada fue de 8,7% en capturadores de cangrejo rojo y de 0,5% en población general, siendo el riesgo relativo de 16,2 (intervalo de confianza del 95%: 2,1-127,4). El coste total de la asistencia sanitaria y de las pérdidas por enfermedad asociadas a la leptospirosis fue de 1568 € por caso.
ConclusionesLa leptospirosis en Isla Mayor está fuertemente asociada a la captura del cangrejo rojo. La incidencia es muy superior a la encontrada en estudios publicados en otros países.
To find out whether the leptospirosis incidence rate among red swamp crayfish collectors in the harvesting season is higher than in the general population, and to identify risk factors and assess the direct and indirect health costs associated with leptospirosis seroconversion.
MethodThis study was carried out between 1 July 2017 and 31 March 2018 in the municipality of Isla Mayor (Seville, Spain). It took the form of a prospective cohort study (exposed population: swamp crayfish collectors; non-exposed population: general population). The population was invited to take part in a prevalence study to be conducted using the ELISA qualitative technique, and informed consent was obtained from those who agreed. Negative serology cases were then included in the cohort study. Both cohorts were monitored clinically and symptomatic cases were serology tested. A second serum sample was taken from the swamp crayfish collectors at the end of the monitoring period to detect asymptomatic cases. Serovars were confirmed by microscopic agglutination testing. A bivariate descriptive analysis was carried out and cumulative incidence and relative risk were calculated, with positive serology being taken as the dependent variable.
ResultsA total of 278 people were included in the study, of whom 92 made up the swamp crayfish collectors cohort and 186 the general population cohort. Women made up 46.8% of the sample, but only 29.3% of the collectors cohort. The mean age was 45.1 (±16.4) years. Nine cases of seroconversion were detected: eight among swamp crayfish collectors and one in the general population. Overall cumulative incidence was therefore 3.2%: 8.7% in the exposed group and 0.5% in the non-exposed group. Relative risk was 16.2% (95% confidence interval: 2.1-127.4). The total cost of medical assistance and illness-related losses associated with leptospirosis was 1568€/case.
ConclusionsLeptospirosis in Isla Mayor is strongly associated with red swamp crayfish collecting. It's incidence here is much higher than that reported in studies published in other countries.
La leptospirosis, conocida coloquialmente como «fiebre de la rata», es una enfermedad zoonótica de distribución mundial, causada por espiroquetas del género Leptospira1. Su incidencia puede estar infravalorada en áreas con acceso limitado a pruebas diagnósticas y en ausencia de declaración obligatoria de los casos2,3. Hay pocos estudios publicados y la mayoría relacionados con la enfermedad de Weil4–7.
Isla Mayor es un municipio constituido por dos núcleos de población principales: Isla Mayor y el Poblado de Alfonso XIII. Tiene una extensión de 114,5km2 y está completamente rodeado por más de 24.000 hectáreas de arrozales. Forma parte del área del Preparque y el Parque Nacional de Doñana, un ecosistema natural protegido por su biodiversidad. Esta protección conlleva la prohibición del uso de toda sustancia química biocida que pueda dañarlo. El sobrecrecimiento de ratas, asociado a la riqueza de este ecosistema y a la limitación del uso de biocidas, han convertido a Isla Mayor en un enclave óptimo para la infección por leptospiras de las personas que trabajan en los humedales, en especial los que se dedican al cultivo del arroz y los capturadores de cangrejo rojo (Procambarus clarkii).
Los capturadores de cangrejo rojo trabajan sumergiendo en el agua y el lodo sus pies y manos. Las altas temperaturas durante su jornada laboral en los meses de junio a octubre determinan que casi la totalidad de los profesionales prescindan de los equipos de protección (guantes y botas o vadeadores) frente a heridas y a los patógenos que viven en las aguas estancadas. Los capturadores de cangrejo rojo trabajan por cuenta propia, como proveedores de las cinco empresas isleñas dedicadas al comercio y la transformación de dicha especie. Estas empresas se han convertido en el segundo exportador mundial de cangrejo rojo tras China, generando unos 200.000 jornales y 400 empleos directos, principalmente en Isla Mayor y los municipios del entorno8.
En un estudio realizado en los humedales de Doñana9 por este mismo equipo de investigación, se encontró que la prevalencia de leptospirosis fue del 5,4%. En España, la leptospirosis es una enfermedad de declaración obligatoria que ha incrementado su incidencia en los humedales de Doñana.
A tenor de los datos, y basándonos en la población analizada en el estudio de prevalencia antes citado9, se diseñó un estudio prospectivo para conocer si la incidencia de leptospirosis en los capturadores de cangrejo rojo durante el periodo de captura es superior a de la población general, así como identificar factores de riesgo y estimar los costes sanitarios directos e indirectos asociados a los casos de seroconversión de dicha enfermedad.
MétodoA partir de los datos del estudio descriptivo transversal realizado en junio de 2017, por el que se determinó la prevalencia de la leptospirosis en Isla Mayor, se diseñó un estudio de cohortes prospectivo en el que la cohorte de expuestos estaba formada por los capturadores de cangrejo rojo que trabajaban en los humedales del municipio de Isla Mayor, y la cohorte de no expuestos estaba formada por la población general. Este estudio se realizó desde el 1 de julio de 2017 hasta el 31 de marzo de 2018, con el fin de detectar todos los casos que pudieran aparecer a lo largo del periodo de captura (periodo de exposición), el cual se extiende habitualmente de julio a finales de octubre. Para el estudio de prevalencia se extrajo del padrón municipal la población residente en Isla Mayor y el Poblado de Alfonso XIII. Dicha población se estratificó por edad (6-15 años, 16-64 años y>65 años), sexo (hombre o mujer) y grupo de riesgo (capturadores de cangrejo rojo o población general, en una relación 1:2).
Se invitó a participar en el estudio de incidencia a los sujetos cuya serología había sido negativa en el estudio de prevalencia previo.
Se calculó el tamaño muestral utilizando la aproximación de Poisson, asumiendo una tasa de enfermos en el grupo de no expuestos del 0,031, aceptando un riesgo alfa de 0,05 y un riesgo beta de 0,1 en un contraste bilateral, y asumiendo una tasa de pérdidas de seguimiento del 40%. Así se definió una muestra mínima de 41 sujetos en el grupo de expuestos y de 82 en el de no expuestos, para detectar un riesgo relativo de 10. Debido a la suficiencia de recursos y a la decisión por parte de los individuos seronegativos (que participaron en el estudio de prevalencia) de continuar en el estudio de incidencia, la muestra incorporada finalmente en el estudio de cohortes fue de 278, de los cuales 92 formaron la cohorte de expuestos (capturadores de cangrejo rojo) y 186 la cohorte de no expuestos (población general). Después de recibir información del proyecto, se pidió a los participantes su consentimiento por escrito para ser incluidos en el estudio.
La detección de anticuerpos IgG se realizó mediante una técnica cualitativa de ELISA con antígenos de Leptospira spp. (SERION ELISA classic Leptospira IgG®). Las muestras positivas fueron confirmadas por un laboratorio de referencia (Neiker Tecnalia) mediante técnica de microaglutinación microscópica, que utiliza antígenos de leptospiras vivas de los serogrupos Bratislava, Canicola, Grippothyposa, Hardjo, Icterohemorragiae y Pomona.
A todos los capturadores se les realizó un seguimiento clínico durante todo el periodo de exposición (periodo de captura) y hasta 3 meses después de este para detectar seroconversiones. A aquellos capturadores que no presentaron sintomatología ni prueba serológica compatible con leptospirosis aguda (casos nuevos) durante el seguimiento y consintieron, se les realizó una serología al finalizar el estudio para identificar casos no detectados por el sistema sanitario, porque no hubieran acudido a este o por haber tenido una leptospirosis asintomática u oligosintomática. En la población general se hizo un seguimiento clínico, excepto en aquellas personas con sintomatología compatible con leptospirosis, a quienes también se les realizó serología de confirmación.
Al ser una enfermedad de declaración obligatoria en España y participar en el estudio la unidad de microbiología y enfermedades infecciosas del hospital de referencia, el seguimiento clínico de los casos sospechosos y confirmados fue exhaustivo. De hecho, el 100% de los casos se identificaron tras una sospecha clínica. Para mejorar la sensibilidad diagnóstica se hizo una formación continua de los profesionales de atención primaria y se definieron los algoritmos de flujo de pacientes tanto en atención primaria como en las urgencias y las consultas hospitalarias. Para sensibilizar a la población objeto de estudio se les dio información para fomentar que acudieran al sistema sanitario precozmente ante la aparición de síntomas de sospecha (fiebre, cefalea, poliartromialgias, ictericia, etc.).
Pasado el periodo de captura del cangrejo rojo, en el mes de marzo de 2018, se tomaron las segundas muestras de sangre para detectar las seroconversiones.
La presencia de anticuerpos de tipo IgG frente a Leptospira spp. (serología positiva) durante el seguimiento o en la serología final, es decir, la seroconversión, se consideró como variable dependiente. Las variables independientes fueron la edad, el sexo, el uso de equipos de protección individual, tener antecedentes de síntomas compatibles con «fiebre de la rata» y la exposición a animales de riesgo (animales domésticos como perros, cerdos y caballos, entre otros) que pudieran ser portadores de leptospiras. Las variables de estudio se recogieron mediante un cuestionario basado en la encuesta epidemiológica de leptospirosis (disponible en: https://juntadeandalucia.es/export/drupaljda/salud_5af95879ccebd_leptospirosis.pdf) y una serie de parámetros necesarios para el estudio que se obtuvieron de la historia clínica del usuario, tanto de atención primaria (DIRAYA) como de atención hospitalaria (Estación Clínica) y de la base de datos de Enfermedades de Declaración Obligatoria (RedAlerta). Todos los parámetros fueron registrados en una hoja de cálculo diseñada ad hoc.
Se realizó un análisis estadístico descriptivo utilizando el número y el porcentaje para las variables cualitativas, y la media (desviación típica) y su intervalo de confianza del 95% (IC95%). Se utilizaron tablas de contingencia y el test de Fisher en el análisis bivariado para determinar la asociación entre el estado de seroconversión y las variables cualitativas, y el test t de Student para muestras independientes para analizar la asociación con la edad. Además, se calcularon la incidencia acumulada para el periodo de estudio (julio de 2017 a marzo de 2018, que incluye el periodo de exposición de riesgo en los humedales) y el riesgo relativo. Se usó el software IBM SPSS Statistics 22, considerando como nivel de significación el 5% y técnicas de contraste bilateral.
El análisis económico se realizó desde una perspectiva social, incluyendo los costes sanitarios asociados al consumo de recursos sanitarios y los costes indirectos asociados a las pérdidas de productividad por seroconversión de leptospirosis. Los costes sanitarios se estimaron de acuerdo con los precios públicos del Sistema Sanitario Público de Andalucía10, incluyendo asistencia primaria y hospitalaria relacionada con seroconversión por leptospirosis: a) consultas de atención primaria, b) visitas a urgencias hospitalarias, c) consultas de atención especializada, y d) hospitalizaciones.
El coste indirecto asociado a las pérdidas de productividad por leptospirosis se estimó según el coste laboral11. Los resultados del análisis económico se expresaron en unidades monetarias del año 2018.
Este proyecto fue aprobado por el Comité de Bioética de la Investigación de los Hospitales Virgen del Rocío-Virgen Macarena. Durante el estudio se dio cumplimiento a la legislación vigente reguladora de la investigación con seres humanos y se mantuvo el anonimato de los pacientes. Todas las personas participantes firmaron el consentimiento informado antes de iniciar su participación en el proyecto. Este trabajo ha sido financiado por la Fundación Progreso y Salud de la Consejería de Salud de la Junta de Andalucía (número de registro: AP-0131-2017).
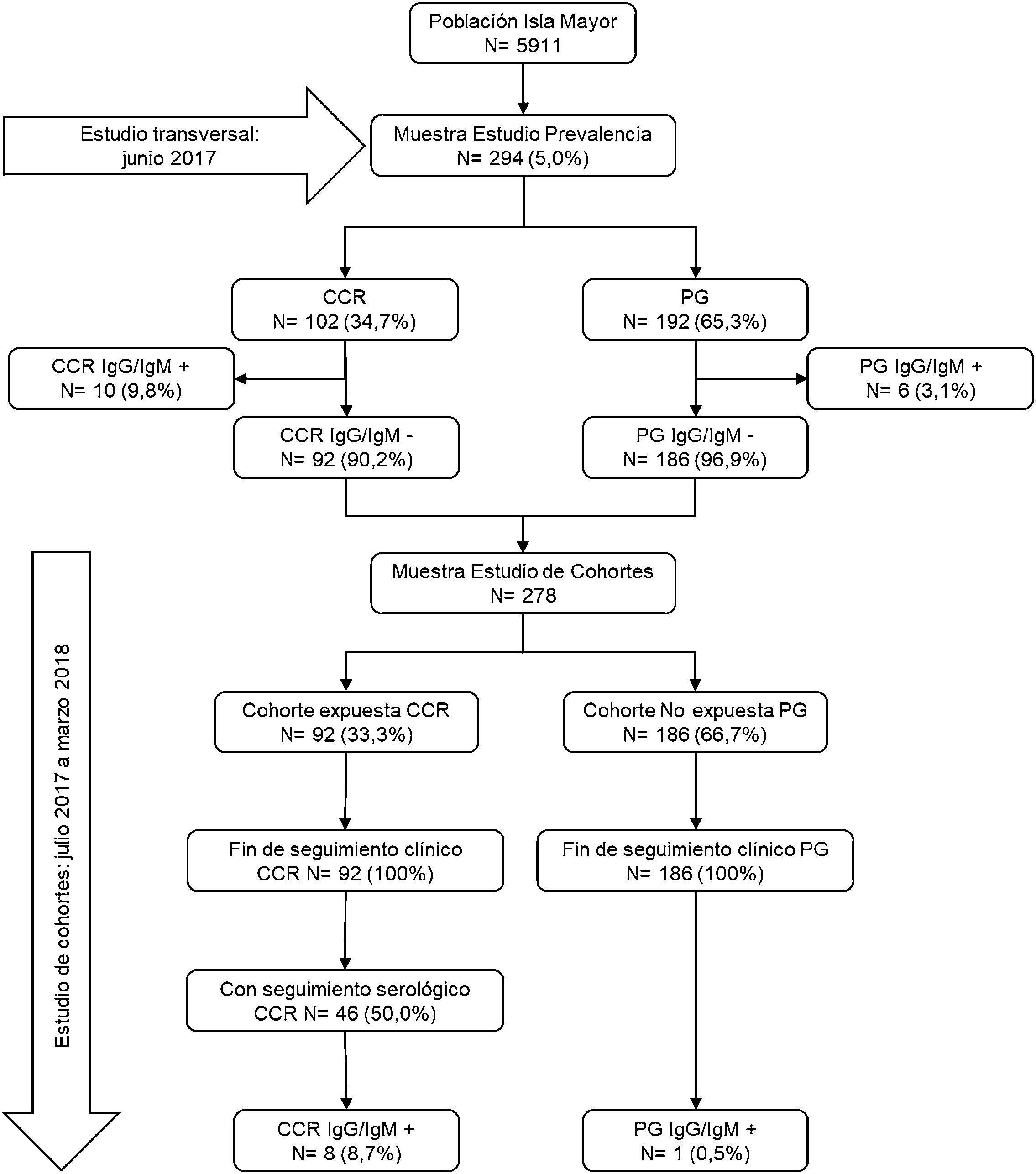
ResultadosSe aleatorizó una muestra de 294 personas (5% de la población de Isla Mayor). Tras excluir los seropositivos del estudio de prevalencia, la muestra quedó conformada por dos cohortes: la de capturadores de cangrejo rojo con 92 participantes y la de población general con 186 personas (fig. 1).
Los 92 capturadores de cangrejo rojo que iniciaron su participación en el estudio fueron seguidos clínicamente hasta el final de este, pero solo 46 (50%) consintieron realizarse la segunda extracción de sangre para determinar la seroconversión; ninguno de los sujetos asintomáticos presentó serología positiva para Leptospira. De los 92 capturadores de cangrejo rojo, ocho (8,7%) mostraron seroconversión, frente a una sola persona de la población general (0,5%), por lo que la incidencia acumulada fue de 0,087 en los capturadores de cangrejo rojo y de 0,0054 en la población general, y el riesgo relativo fue de 16,2 (IC95%: 2,1-127,4).
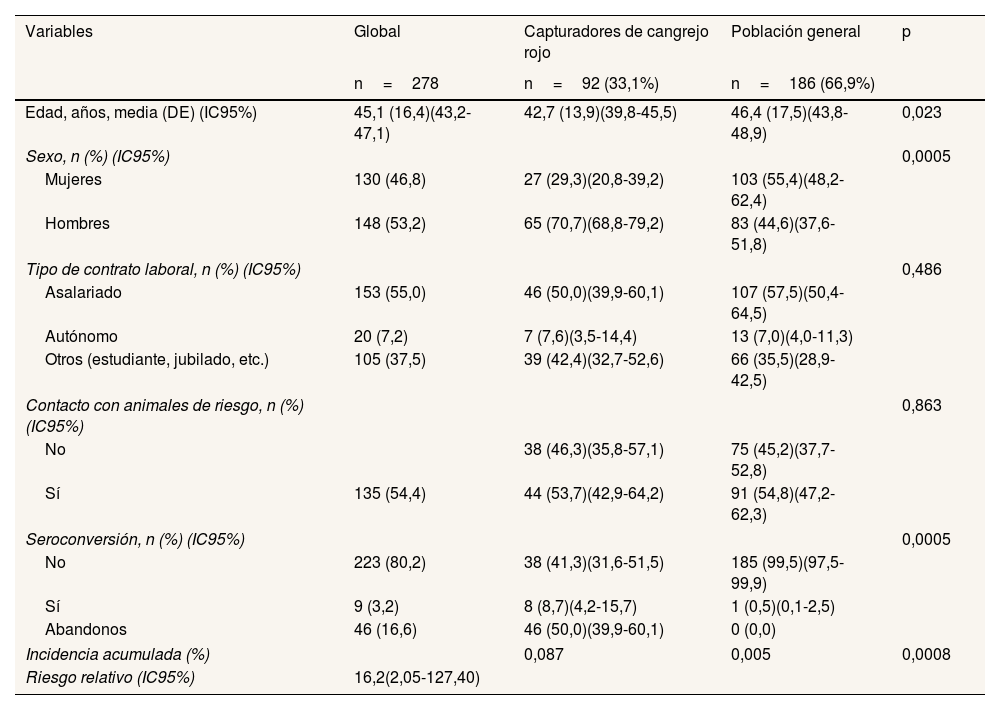
La edad media de los participantes en el estudio fue de 45,1 años (desviación estándar [DE]: 16,4; IC95%: 43,2-47,1), siendo significativamente menor en el grupo de capturadores de cangrejo rojo (42,7±13,9 años) que en la población general (46,4±17,5 años). Del total, 148 (53,2%) eran hombres, pero la distribución de hombres por grupo de estudio fue dispar: el 70,7% en el grupo de capturadores de cangrejo rojo y el 44,6% en la población general. En cuanto a la actividad laboral, no se encontraron diferencias estadísticamente significativas entre ambas poblaciones, aunque cabe destacar que la mitad de las personas eran asalariadas (el 55,5% de la muestra global).
Excluyendo el contacto con roedores, la exposición a animales de riesgo (perros, cerdos y caballos, entre otros) fue mayor en la población general que en los capturadores de cangrejo rojo. Las características de ambas poblaciones quedan recogidas en la tabla 1.
Descripción de las variables sociodemográficas en la población de estudio
| Variables | Global | Capturadores de cangrejo rojo | Población general | p |
|---|---|---|---|---|
| n=278 | n=92 (33,1%) | n=186 (66,9%) | ||
| Edad, años, media (DE) (IC95%) | 45,1 (16,4)(43,2-47,1) | 42,7 (13,9)(39,8-45,5) | 46,4 (17,5)(43,8-48,9) | 0,023 |
| Sexo, n (%) (IC95%) | 0,0005 | |||
| Mujeres | 130 (46,8) | 27 (29,3)(20,8-39,2) | 103 (55,4)(48,2-62,4) | |
| Hombres | 148 (53,2) | 65 (70,7)(68,8-79,2) | 83 (44,6)(37,6-51,8) | |
| Tipo de contrato laboral, n (%) (IC95%) | 0,486 | |||
| Asalariado | 153 (55,0) | 46 (50,0)(39,9-60,1) | 107 (57,5)(50,4-64,5) | |
| Autónomo | 20 (7,2) | 7 (7,6)(3,5-14,4) | 13 (7,0)(4,0-11,3) | |
| Otros (estudiante, jubilado, etc.) | 105 (37,5) | 39 (42,4)(32,7-52,6) | 66 (35,5)(28,9-42,5) | |
| Contacto con animales de riesgo, n (%) (IC95%) | 0,863 | |||
| No | 38 (46,3)(35,8-57,1) | 75 (45,2)(37,7-52,8) | ||
| Sí | 135 (54,4) | 44 (53,7)(42,9-64,2) | 91 (54,8)(47,2-62,3) | |
| Seroconversión, n (%) (IC95%) | 0,0005 | |||
| No | 223 (80,2) | 38 (41,3)(31,6-51,5) | 185 (99,5)(97,5-99,9) | |
| Sí | 9 (3,2) | 8 (8,7)(4,2-15,7) | 1 (0,5)(0,1-2,5) | |
| Abandonos | 46 (16,6) | 46 (50,0)(39,9-60,1) | 0 (0,0) | |
| Incidencia acumulada (%) | 0,087 | 0,005 | 0,0008 | |
| Riesgo relativo (IC95%) | 16,2(2,05-127,40) | |||
DE: desviación estándar; IC95%: intervalo de confianza del 95%.
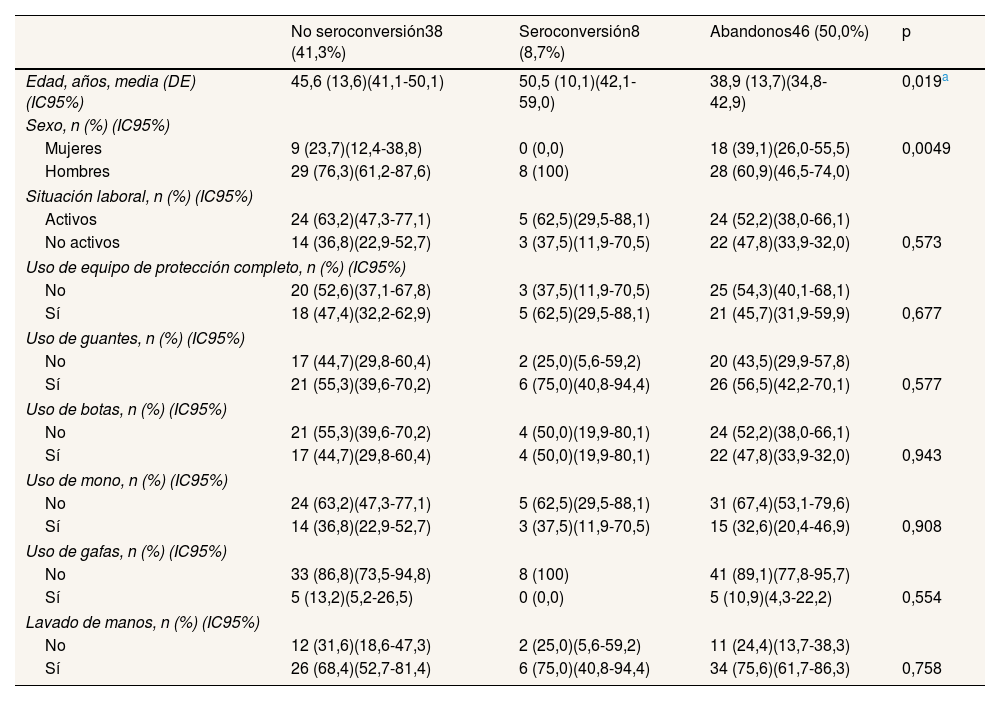
El análisis de las variables relacionadas con el uso de equipos de protección individual no muestra relación estadísticamente significativa con la aparición de la enfermedad (tabla 2).
Descripción de los posibles (a priori) factores de riesgo de leptospirosis en la población de estudio
| No seroconversión38 (41,3%) | Seroconversión8 (8,7%) | Abandonos46 (50,0%) | p | |
|---|---|---|---|---|
| Edad, años, media (DE) (IC95%) | 45,6 (13,6)(41,1-50,1) | 50,5 (10,1)(42,1-59,0) | 38,9 (13,7)(34,8-42,9) | 0,019a |
| Sexo, n (%) (IC95%) | ||||
| Mujeres | 9 (23,7)(12,4-38,8) | 0 (0,0) | 18 (39,1)(26,0-55,5) | 0,0049 |
| Hombres | 29 (76,3)(61,2-87,6) | 8 (100) | 28 (60,9)(46,5-74,0) | |
| Situación laboral, n (%) (IC95%) | ||||
| Activos | 24 (63,2)(47,3-77,1) | 5 (62,5)(29,5-88,1) | 24 (52,2)(38,0-66,1) | |
| No activos | 14 (36,8)(22,9-52,7) | 3 (37,5)(11,9-70,5) | 22 (47,8)(33,9-32,0) | 0,573 |
| Uso de equipo de protección completo, n (%) (IC95%) | ||||
| No | 20 (52,6)(37,1-67,8) | 3 (37,5)(11,9-70,5) | 25 (54,3)(40,1-68,1) | |
| Sí | 18 (47,4)(32,2-62,9) | 5 (62,5)(29,5-88,1) | 21 (45,7)(31,9-59,9) | 0,677 |
| Uso de guantes, n (%) (IC95%) | ||||
| No | 17 (44,7)(29,8-60,4) | 2 (25,0)(5,6-59,2) | 20 (43,5)(29,9-57,8) | |
| Sí | 21 (55,3)(39,6-70,2) | 6 (75,0)(40,8-94,4) | 26 (56,5)(42,2-70,1) | 0,577 |
| Uso de botas, n (%) (IC95%) | ||||
| No | 21 (55,3)(39,6-70,2) | 4 (50,0)(19,9-80,1) | 24 (52,2)(38,0-66,1) | |
| Sí | 17 (44,7)(29,8-60,4) | 4 (50,0)(19,9-80,1) | 22 (47,8)(33,9-32,0) | 0,943 |
| Uso de mono, n (%) (IC95%) | ||||
| No | 24 (63,2)(47,3-77,1) | 5 (62,5)(29,5-88,1) | 31 (67,4)(53,1-79,6) | |
| Sí | 14 (36,8)(22,9-52,7) | 3 (37,5)(11,9-70,5) | 15 (32,6)(20,4-46,9) | 0,908 |
| Uso de gafas, n (%) (IC95%) | ||||
| No | 33 (86,8)(73,5-94,8) | 8 (100) | 41 (89,1)(77,8-95,7) | |
| Sí | 5 (13,2)(5,2-26,5) | 0 (0,0) | 5 (10,9)(4,3-22,2) | 0,554 |
| Lavado de manos, n (%) (IC95%) | ||||
| No | 12 (31,6)(18,6-47,3) | 2 (25,0)(5,6-59,2) | 11 (24,4)(13,7-38,3) | |
| Sí | 26 (68,4)(52,7-81,4) | 6 (75,0)(40,8-94,4) | 34 (75,6)(61,7-86,3) | 0,758 |
DE: desviación estándar; IC95%: intervalo de confianza del 95%.
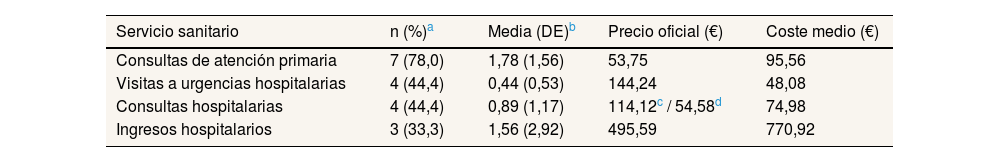
En la tabla 3 se detalla el consumo de recursos sanitarios de los nueve casos asociados a leptospira, incluyendo asistencia primaria y hospitalaria.
Consumo de recursos sanitarios y coste sanitario estimado para los nueve casos positivos para leptospira
| Servicio sanitario | n (%)a | Media (DE)b | Precio oficial (€) | Coste medio (€) |
|---|---|---|---|---|
| Consultas de atención primaria | 7 (78,0) | 1,78 (1,56) | 53,75 | 95,56 |
| Visitas a urgencias hospitalarias | 4 (44,4) | 0,44 (0,53) | 144,24 | 48,08 |
| Consultas hospitalarias | 4 (44,4) | 0,89 (1,17) | 114,12c / 54,58d | 74,98 |
| Ingresos hospitalarios | 3 (33,3) | 1,56 (2,92) | 495,59 | 770,92 |
DE: desviación estándar.
Respecto al impacto social de la enfermedad, dos de los nueve pacientes (22,2%) presentaron incapacidad temporal relacionada con la seroconversión para leptospira, con bajas laborales de 15 y 45 días que representan una pérdida media de productividad por episodio de 30 (DE: 21,2) días.
La valoración monetaria de los recursos sanitarios se realizó basándose en los precios públicos de los servicios sanitarios prestados por centros dependientes del Sistema Sanitario Público de Andalucía, expresados en euros. También en la tabla 3 se muestra el coste medio sanitario estimado según los datos obtenidos para los nueve pacientes que presentaron seroconversión para leptospira. El coste se calculó según los valores medios de la asistencia sanitaria, obteniendo un coste sanitario de 989,53 € por caso positivo de leptospirosis.
El impacto social asociado a las pérdidas de productividad se calculó según el coste laboral, estimándose un coste medio indirecto de 578,22 €. El coste medio para los dos pacientes que presentaron incapacidad temporal relacionada con la seroconversión para leptospira se estimó en 2602,01 €.
Según estos resultados, el coste total por caso de seroconversión para leptospira se estimó en 1567,76 €, representando la asistencia sanitaria un 63% del total.
DiscusiónEste estudio ha permitido poner de manifiesto que la incidencia acumulada en los profesionales capturadores de cangrejo rojo es del 17,4%. Los capturadores son mayoritariamente hombres jóvenes, lo que explica que la seroconversión solo haya ocurrido en hombres. Probablemente el tipo de tarea durante la captura que realizan hombres y mujeres es diferente, con mayor exposición al agua en el caso de los hombres.
En un estudio realizado en los humedales de Doñana9 se encontró que la prevalencia de leptospirosis fue del 5,4%, siendo más alta en los capturadores de cangrejo rojo (9,8%) que en los arroceros (3,2%) y la población general (3,1%). Los principales factores de riesgo para la presencia de anticuerpos fueron la ocupación laboral y el sexo. El riesgo de los capturadores de cangrejo rojo fue tres veces mayor (odds ratio [OR]: 3,40; IC95%: 1,03-11,17; p=0,044) que el de la población general, mientras que los arroceros no presentan un riesgo significativo (OR: 1,03; IC95%: 0,18-5,75; p=0,978).
Además, se ha encontrado que la incidencia de leptospirosis es de 118,42 por 100.000 habitantes en los humedales de Isla Mayor, siendo ambas medidas epidemiológicas superiores a las de otros estudios españoles de ciudades vecinas con climas parecidos, y también a las de otros estudios europeos12,13. El municipio de Isla Mayor es considerado el mayor productor de arroz de España y una de las potencias mundiales en la producción de este cereal.
En los estudios realizados en otros países se encuentran cifras más bajas. En un estudio retrospectivo llevado a cabo en Brasil durante el periodo 2000-2016 se determinó un pico de incidencia en 2008, cuando se alcanzó una tasa de incidencia de 39-78 por 100.000 habitantes, seguido de otro pico inferior en 201114. En el estudio de Klement-Frutos et al.15, realizado en Nueva Caledonia entre 2006 y 2016, se identificó una incidencia anual media de 30,6 por 100.000 habitantes. Y en el sur de Europa, en concreto en Grecia, Gkentzi et al.16 encontraron una tasa de incidencia media anual de 1,1 por 100.000 habitantes. Todas ellas son cifras muy inferiores a las determinadas en nuestro estudio.
Los factores de riesgo de exposición ambiental, ocupacional y recreativa asociados con la leptospirosis en zonas de clima cálido o templadas son conocidos, aunque su importancia puede ser variable17,18. Dastis-Bendala et al.12 describieron por primera vez como población de riesgo a los capturadores de cangrejo rojo, con una densidad de incidencia de 19,38 por 100 personas por año, y en su estudio de prevalencia destacan como factor de riesgo de infección las actividades relacionadas con aguas estancadas. Estos autores encontraron una seroprevalencia del 62,7% en los capturadores de cangrejo rojo y del 30,3% en los arroceros, mientras que en el estudio de Gómez et al.9 en la población de Isla Mayor estas cifras son del 9,8% y el 3,1%, respectivamente. Las diferencias encontradas entre el estudio de Dastis et al.12 y el de Gómez et al.9 pueden atribuirse a que en el tiempo transcurrido entre ambos se ha producido un relevante aumento de la mecanización de las actividades realizadas por los arroceros.
Por otro lado, la edad media de los que presentaron seroconversión es mayor que la de aquellos que no desarrollaron anticuerpos a lo largo del periodo de seguimiento, siendo esta de 50,5 años, similar a la del estudio de Gkentzia et al.16, en el que era de 55,5 años.
En cuanto al sexo de quienes presentaron seroconversión, el 100% eran hombres. Esta diferencia entre sexos puede deberse al rol de los hombres en el proceso de captura, pues principalmente son ellos quienes sacan las nasas de cangrejos del agua estancada de las tablas de arroz con sus pies y manos sumergidos en este medio contaminado por la orina de las ratas infectadas por Leptospira spp. Las heridas que sufren en los brazos y las piernas pueden ser la vía de entrada principal de la espiroqueta. Probablemente, tener una licencia de capturador no signifique que la persona esté trabajando dentro del humedal, sino que puede estar trabajando como personal de apoyo en tierra seca. Los estudios de observación directa podrían identificar esta diferencia de riesgo de contagio entre hombres y mujeres.
La mayoría de los estudios publicados relacionan la aparición de brotes con factores ambientales, como inundaciones, o con la práctica de actividades recreativas en aguas estancadas. Solo algunos estudios han tipificado su análisis por ocupación laboral19–24, pero ninguno, excepto el de Dastis et al.12, lo relacionan con la captura del cangrejo rojo.
Las estrategias para la prevención de la leptospirosis se deben basar en el conocimiento de la epidemiología local de esta enfermedad y sus mecanismos de transmisión. En el presente trabajo se demuestra que una actividad laboral, como es la captura del cangrejo rojo, en una zona de clima templado con una alta población de roedores, es un factor de riesgo relevante para la infección por Leptospira spp. incluso si se compara con actividades similares realizadas en el mismo entorno.
Aunque desde una perspectiva global la leptospirosis humana está asociada a zonas económicamente desfavorecidas, en nuestro estudio la única variable social con la que hemos relacionado la leptospirosis es la ocupación laboral, en concreto la captura del cangrejo rojo.
Las diferencias encontradas entre sexos plantean la duda de si las mujeres tienen el mismo grado de exposición al agua contaminada que los hombres. Responder esta cuestión nos obligaría a conocer detalladamente la labor que desempeña cada sexo en la captura del cangrejo rojo.
También hay que tomar los resultados con cierta cautela, ya que se trata de datos autodeclarados y puede haber un sesgo de respuesta por parte de los individuos del primer grupo, pues pueden entender que si reconocen no usar las medidas de protección se les puede estar responsabilizando de haberse infectado.
La población de estudio tiene ciertas características sociodemográficas (nivel cultural bajo, empleados autónomos, empleo temporal, etc.) que pueden estar influyendo en un menor acceso al sistema sanitario y a la participación en este estudio.
Son necesarios estudios de diseño cualitativo con el fin de identificar factores sociodemográficos y laborales que puedan explicar las diferencias encontradas.
ConclusionesLa leptospirosis en Isla Mayor está fuertemente asociada a la captura del cangrejo rojo, siendo esta la principal actividad económica del municipio junto con la recolección de arroz. La incidencia en esta zona es muy superior a la reportada por estudios recientes realizados en otros países. No se han encontrado mujeres con seroconversión, probablemente por el rol que desempeñan en el proceso de captura.
Los casos de seroconversión por leptospirosis se concentraron en la población de riesgo. Si bien la prevalencia es baja, el coste total de la asistencia sanitaria y de las pérdidas de productividad asociadas a la enfermedad se estimaron en 1568 € por caso. La asistencia sanitaria fue el componente más importante del coste global, representando el 63% del total.
Aunque los capturadores de cangrejos rojos son conocedores de la enfermedad y de las medidas preventivas que deben adoptar, en concreto el uso de equipos de protección adecuados, las características de su trabajo y la temporada en que lo realizan (fundamentalmente en los meses de verano y en humedales a altas temperaturas) dificultan su cumplimiento, por lo que es importante un diagnóstico precoz para minimizar el riesgo de complicaciones graves de la enfermedad. En caso de disponer de unidades de salud laboral, estas deberían incidir en informar a los trabajadores sobre la enfermedad, el uso de equipos de protección individual y que deben comunicarse con el sistema sanitario en caso de presentar síntomas compatibles. Si no se dispone de dichas unidades, el sistema sanitario debe asumir estas funciones, por lo que es importante que los profesionales sanitarios estén formados y preparados en el manejo de la leptospirosis. Por estos motivos se ha desarrollado una guía para profesionales sobre leptospirosis en humedales y se ha creado una tarjeta de identificación para los capturadores de cangrejo rojo. En esta tarjeta se les facilita información y se indican las vías de contacto con el sistema sanitario para comunicar que presentan sintomatología compatible con leptospirosis.
La leptospirosis es una zoonosis vinculada a animales infectados por Leptospira spp. y es una enfermedad de declaración obligatoria en España. Su prevalencia en los humedales de Doñana es del 5,4%. Los capturadores de cangrejo rojo son una población de alto riesgo de leptospirosis.
¿Qué añade el estudio realizado a la literatura?La incidencia acumulada de leptospirosis en los humedales de Doñana es del 17,4%. El coste total asociado a la leptospirosis es de 1568 € por caso. Este estudio ha generado una guía clínica para su diagnóstico y tratamiento.
¿Cuáles son las implicaciones de los resultados obtenidos?Los capturadores de cangrejo rojo se deben considerar una población de riesgo de leptospirosis y someterse a una vigilancia específica desde atención primaria.
Carlos Álvarez-Dardet.
Declaración de transparenciaLa autora principal (garante responsable del manuscrito) afirma que este manuscrito es un reporte honesto, preciso y transparente del estudio que se remite a Gaceta Sanitaria, que no se han omitido aspectos importantes del estudio, y que las discrepancias del estudio según lo previsto (y, si son relevantes, registradas) se han explicado.
Contribuciones de autoríaM.C. Gómez Martín coordina como investigadora principal la redacción del proyecto, su seguimiento, la organización del muestreo de campo y las reuniones del equipo. L.M. Rodríguez-Benjumeda realiza el estudio epidemiológico y el seguimiento de la declaración de casos. M.C. Lozano-Domínguez se encarga de la gestión y la realización del análisis serológico. L.G. Luque-Romero coordina la redacción de resultados, el estudio estadístico y es el responsable del envío del manuscrito y de la correspondencia con el Comité Editorial de Gaceta Sanitaria. R. Luque-Márquez se encarga del análisis clínico de los casos de leptospirosis y el seguimiento de los casos. F. Jódar Sánchez realiza el análisis estadístico. J. Aznar-Martín coordina el estudio microbiológico del proyecto y su redacción. L.G. Luque-Romero, M.C. Gómez-Martín, José Augusto Donaire-Granado y Luis Miguel Rodríguez-Benjumeda fueron los autores de la redacción del primer borrador y de sus sucesivas revisiones. Francisco Jódar-Sánchez ha sido el responsable de la redacción de la metodología, resultados y discusión del análisis económico. M.C. Lozano-Domínguez, Rafael Luque-Márquez y J. Aznar-Martín, ha colaborado en la revisión del primer borrador y de las modificaciones de las versiones posteriores. Todas las personas incluidas como autores de este artículo han aprobado el contenido del mismo.
AgradecimientosAgradecemos a los miembros del grupo de investigación de leptospirosis del D.S. Aljarafe-Sevilla Norte su participación en este estudio: María Pilar Sánchez de Medina Martínez, Berta Alcón-Álvarez, Joaquín J. Torres-Peral y Rosario Vigo Ortega; y a Gorka Aduriz por la realización de las pruebas de microaglutinación microscópica.
FinanciaciónEste trabajo ha sido financiado por la Fundación Progreso y Salud de la Consejería de Salud de la Junta de Andalucía (número de registro: AP-0131-2017).
Conflictos de interesesNinguno.