Informe SESPAS 2022: La respuesta a la pandemia de COVID-19
More infoLa pandemia de COVID-19 ha hecho evidente la importancia de la interfaz animal-humano-medio ambiente en la emergencia de zoonosis. A pesar de que el salto de especie se considera un evento raro, el número de enfermedades infecciosas emergentes aumentó de manera significativa en la segunda mitad del siglo xx, siendo estas principalmente de carácter zoonótico y originadas en la fauna silvestre. Entre los determinantes asociados a la emergencia de zoonosis destacan la interacción humana con los ecosistemas, la pérdida de biodiversidad, los cambios en el uso del suelo, el cambio climático, el comercio y el consumo de fauna silvestre, etc. En el proceso del salto de especie existen diferentes fases de adaptación evolutiva entre el patógeno y la especie humana, variando desde su presencia en el reservorio animal sin infección humana hasta enfermedades exclusivamente humanas sin otros reservorios. El conocimiento de la evolución natural de las zoonosis permite identificar los puntos críticos para su control, al tiempo que posibilita identificar posibles candidatos para futuras pandemias. De forma específica, los avances en el conocimiento de los posibles reservorios del SARS-CoV-2 han contribuido a la toma de decisiones durante la pandemia. Por todo ello, y ante la variedad de escenarios que posibilitan el salto de especie y la evolución de los diferentes patógenos en un nuevo huésped, la vigilancia frente a la emergencia de zoonosis debe plantearse bajo la estrategia One Health.
The new pandemic, COVID-19, highlighted the importance of the animal–human–environment interface in the emergence of zoonoses. The jump of the species barrier is considered a rare event although the number of emerging infectious diseases increased significantly in the second half of the 20th century. Most of them transmitted from wildlife to humans. Several elements can contribute to the emergence of zoonoses: human interaction on ecosystems, biodiversity loss, changes in land use, climate change, trade in or consumption of wildlife. There are different stages in the adaptation of an animal pathogen into a specialized human pathogen, varying from its presence in animals without human infection to a pathogen exclusive to humans. The history of zoonoses allows the identification of critical points for their control, as well as the identification of probable virus or bacteria involved in future pandemics. Concerning COVID-19, the knowledge of the possible reservoirs of SARS-CoV-2 contributed to decision-making during the pandemic. Therefore, and given the variety of scenarios that allow the jump of species barrier or the evolution of pathogens in a new host, One Health strategies for zoonosis emergence surveillance should be implemented.
- •
Dado el impacto sanitario, económico y social de infecciones como la COVID-19, las zoonosis representan uno de los factores limitantes del desarrollo humano que se han de considerar.
- •
Entre los determinantes asociados a la emergencia de zoonosis destacan la interacción humana con los ecosistemas, la pérdida de biodiversidad, los cambios en el uso del suelo, el cambio climático y el comercio y consumo de fauna silvestre, que facilitan la interacción de los agentes infecciosos y la especie humana.
- •
El conocimiento de la receptividad y la sensibilidad que muestran diferentes especies animales frente al SARS-CoV-2ha permitido abordar actuaciones específicas durante la pandemia con relación a los posibles hospedadores del SARS-CoV-2.
- •
La vigilancia y las estrategias de prevención de las próximas pandemias deben basarse en la coordinación multidisciplinaria bajo la estrategia One Health.
La COVID-19ha vuelto a demostrar la importancia de la interfaz animal-ser humano-medio ambiente en la emergencia de enfermedades infecciosas. Si bien no todas las zoonosis ocasionan pandemias, la mayoría de las pandemias tienen un origen zoonótico, por lo que el conocimiento de los determinantes asociados a estas debe representar la base de las estrategias de prevención.
Las complejas interacciones patógeno-huésped que presentan los agentes compartidos por la especie humana y el resto de los animales obligaron a superar la noción antropocéntrica de enfermedad previa al siglo xix. Así, una vez asumido el concepto de zoonosis, la evolución de la idea One Medicine, durante el siglo xx, hacia la estrategia One Health (tabla 1), surgida a principios del presente siglo, ha intentado responder a los retos sanitarios, sociales y ecológicos que se plantean a escala global1. El concepto derivado queda definido como: «One Health es un enfoque integrado y unificador que pretende equilibrar y optimizar de forma sostenible la salud de las personas, los animales y los ecosistemas. Reconoce que la salud de los seres humanos, los animales domésticos y salvajes, las plantas y el medio ambiente en general (incluidos los ecosistemas) están estrechamente vinculadas y son interdependientes. El enfoque moviliza múltiples sectores, disciplinas y comunidades en diferentes niveles de la sociedad para trabajar juntos con el fin de fomentar el bienestar y hacer frente a las amenazas a la salud y los ecosistemas, al tiempo que se aborda la necesidad colectiva de agua, energía y aire limpios, alimentos seguros y nutritivos, se actúa sobre el cambio climático y se contribuye al desarrollo sostenible» (Joint TripartiteFAO, OIE, WHO and UNEPStatement, 2021) (tabla 1).
Evolución conceptual y desarrollo de la estrategia One Health en la edad contemporánea
| Año | Autor/Organismo | Concepto | Enfoque destacado, definición o documento |
|---|---|---|---|
| 1855 | Rudolf Virchow | Zoonosis | Utilizó por primera vez el término zoonosen para referirse a las enfermedades compartidas entre los seres humanos y el resto de los animales. «Entre la medicina animal y humana no hay líneas divisorias, ni debería haberlas. El objeto es diferente, pero la experiencia obtenida constituye la base de toda medicina.» |
| 1947 | James H. Steele | Veterinary Public Health | Funda la División de Salud Pública Veterinaria en los CDC de los Estados Unidos. Importancia de la epidemiología de las enfermedades zoonóticas en la salud pública |
| 1951 | Grupo mixto OMS/FAO | Zoonosis | «Aquellas enfermedades e infecciones que se transmiten naturalmente de los animales vertebrados al hombre (sic) y viceversa.»a |
| 1964 | Calvin Schwabe | One Medicine | Veterinary Medicine and HumanHealth. El término remarca las similitudes entre la medicina humana y veterinaria, y la necesidad de colaboración para luchar frente a las enfermedades compartidas |
| 2004 | Wildlife Conservation Society | One World, One Health™ | The Manhattan Principles on “One World, One Health”. Establecen las prioridades para combatir las amenazas a la salud humana y animal en el mundo globalizado |
| 2007 | American Medical Association | One Health | One Health resolution. Promociona la colaboración entre la medicina humana y veterinaria |
| 2008 | FAO, OIE, OMS, UNICEF, Banco Mundial y UNSIC | One World, One Health™ | Contributing to One World, One Health™ - A Strategic Framework for Reducing Risks of Infectious Diseases at the Animal-Human-Ecosystems Interface. Dicho marco se define a partir de la experiencia acumulada frente a la gripe aviar |
| 2017 | FAO, OIE y OMSb | One Health | The Tripartite's Commitment. Providing multi-sectoral, collaborative leadership in addressing health challenges. Identifica los objetivos en materia de resistencia antibiótica, seguridad alimentaria, desarrollo de servicios de salud y vigilancia, respuesta e investigación sobre zoonosis |
| 2019 | FAO, OIE y OMS | One Health | Taking a Multisectoral One Health Approach: A Tripartite Guide to Addressing Zoonotic Diseases in Countries. Define mecanismos nacionales de coordinación, comunicación y colaboración multisectoriales para hacer frente a las enfermedades zoonóticas |
| 2021 | FAO, OIE, OMS y UNEP | One Health | Tripartite and UNEP support OHHLEP's definition of “One Health”. Joint Tripartite (FAO, OIE, WHO) and UNEP Statement. Definición y desarrollo del concepto One Health por el One Health High Level Expert Panel (OHHLEP) |
CDC: Centers for Disease Control and Prevention; FAO: Organización de las Naciones Unidas para la Alimentación y la Agricultura; OIE: Organización Mundial de Sanidad Animal; OMS: Organización Mundial de la Salud; UNEP: Programa de Naciones Unidas para el Medio Ambiente; UNICEF: Fondo de las Naciones Unidas para la Infancia; UNSIC: Coordinación del Sistema de las Naciones Unidas para la Gripe.
Desde el punto de vista cuantitativo, las zoonosis representan una de las amenazas más importantes para la salud humana. Se estima que el 61,6% de los agentes patógenos que afectan al ser humano tienen carácter zoonótico. Además, el 75% de los agentes patógenos considerados emergentes en la especie humana infectan a otro huésped animal2–4. En la etiología de las enfermedades infecciosas emergentes cabe destacar que la mayoría (94%) de los virus zoonóticos con capacidad de transmisión interhumana y diseminación global son virus ARN5.
De forma general, las 56 principales zoonosis ocasionan 2500 millones de casos y 2,7 millones de muertes anualmente, siendo uno de los principales obstáculos en la lucha frente a la pobreza que afecta a 1000 millones de ganaderos6. Las pandemias y otras zoonosis emergentes tienen un coste anual de 1 billón de dólares, mientras que las estrategias globales para prevenirlas tendrían un coste de 22.000-31.000 millones al año7.
Ante la importancia de las zoonosis, el presente trabajo pretende revisar los determinantes asociados al salto de especie y los modelos evolutivos de las zoonosis emergentes, así como los aspectos zoonóticos relativos a la COVID-19 y las estrategias de vigilancia de futuras pandemias bajo el prisma One Health.
El salto de la barrera de especie y determinantes asociados a la emergencia de zoonosisLas oportunidades de transmisión de patógenos entre especies están influenciadas por procesos que ocurren desde la escala molecular hasta niveles ecosistémicos, y que requieren la coincidencia de todos ellos, por lo que el salto de especie se ha calificado como un evento relativamente raro. Todos los patógenos deben vencer una serie jerárquica de impedimentos, funcional y cuantitativamente vinculados, para infectar a una nueva especie hospedadora. La superación de dichas barreras ha sido representada gráficamente como una suerte de ventana espacial y temporal que se corresponde con un marco sintético modelizado matemáticamente por Plowright et al.8 en 2017.
En la segunda mitad del siglo xx, el número de enfermedades infecciosas emergentes aumentó de manera significativa. Dichas enfermedades fueron principalmente de carácter zoonótico y, la mayoría de estas (71,8%), tuvieron su origen en fauna silvestre4. La asociación entre el riesgo de emergencia de zoonosis y la biodiversidad de las regiones de referencia pone de manifiesto el impacto que tienen para la salud global las actuaciones humanas sobre el ecosistema4,9. La proliferación de los huéspedes asociados a zoonosis emergentes se incrementa en medios alterados, mientras que en ecosistemas conservados su frecuencia disminuye en favor de aquellos no asociados a enfermedades emergentes10. En este sentido, entre los huéspedes asociados a los virus emergentes de carácter zoonótico destacan cuantitativamente los roedores silvestres, los primates y los murciélagos5.
Al mismo tiempo, entre los factores asociados a la emergencia de las zoonosis cabe señalar las consecuencias derivadas del cambio climático que afectan directamente a la ecología de los vectores (incrementando su supervivencia y su interacción con las especies) y los reservorios11. De forma sinérgica, las modificaciones en el uso del suelo (deforestación, urbanización, incremento de la producción agrícola y ganadera, entre otras) se han asociado con más del 30% de las enfermedades emergentes registradas desde 1960. Además, un elemento constante de preocupación es el comercio internacional de animales. El comercio legal de fauna silvestre se ha multiplicado por cinco en los últimos 14 años, estimándose su valor en 107.000 millones de dólares en 2019, al tiempo que el comercio ilegal alcanza un volumen de negocio de 7000-23.000 millones de dólares anualmente7.
Otros factores asociados a la emergencia de las zoonosis han sido la translocación de especies, la caza y el comercio de carne de animales silvestres, y los mercados no controlados de animales y alimentos5,7,9,12,13.
En este contexto, se estima que existen alrededor de 1,7 millones de virus actualmente no conocidos en mamíferos y aves, y de ellos, entre 631.000 y 827.000 podrían tener la capacidad de infectar a la especie humana7.
Modelo evolutivo de las zoonosis emergentesEn la tabla 2 se relacionan algunos ejemplos de zoonosis originadas en la fauna silvestre. De forma general, se pueden diferenciar dos modelos según los cuales se produce la transmisión de los agentes patógenos desde el reservorio animal a la especie humana14: enfermedades de origen animal en las que la transmisión interhumana se mantiene durante un tiempo limitado o de forma permanente, y enfermedades en las cuales la transmisión horizontal en la especie humana es rara o inexistente.
Zoonosis originadas en la fauna silvestre, hospedadores, localización geográfica y temporal del salto de especie, y factores asociados a este
| Agente patógeno | Hospedador natural | Hospedador nuevo | Año, localización | Factores asociados | Observaciones |
|---|---|---|---|---|---|
| Virus de la inmunodeficiencia humana (HIV-1 y HIV-2) | Chimpancé: (SIVcpz)Mangabeye gris: (SIVsm) | Humanos | 1920,Kinsasa(R.D. Congo) | Caza y consumo de simiosCambios ecológicos y sociales en África | >35 millones de muertes desde 1981 |
| Virus Ébola | Murciélagos | PrimatesAntílopesHumanos | 1976, Sudán (R.D. Congo) | Invasión de tierras para agriculturaCaza, manejo y consumo de hospedadores | Letalidad en humanos: 50-100% |
| Borrelia burgdorferi | Ratón de patas blancas | PerrosHumanos | 1982, Estados Unidos | DeforestaciónIncremento de ciervos, roedoresExpansión urbana | Transmitida por Ixodes spp. |
| Virus Hendra(género Henipavirus) | Murciélagos(Pteropus spp.) | CaballosHumanos | 1994, Australia | Interacción con el ecosistema de los murciélagos | Infecciones humanas a partir de caballos enfermos |
| Virus Nipah(género Henipavirus) | Murciélagos(Pteropus spp.) | CerdosHumanos | 1998-1999, Malasia | DeforestaciónAumento de granjas porcinasInteracción con el ecosistema de los murciélagos | Infecciones humanas a partir de cerdos enfermosLetalidad en humanos: 40% |
| Virus gripe aviar H5N1 | Aves acuáticas | Humanos | 1997, Hong Kong | Interacción fauna silvestre, doméstica y humanos | Letalidad en humanos: 33% |
| Virus del Oeste del Nilo | Aves | CaballosHumanos | 1999a, Estados Unidos | Importado de Oriente MedioCambio climáticoProliferación de aves susceptibles (córvidos, petirrojo americano, etc.) | Transmitido por Culex spp. |
| Virus de la viruela del mono | Perrito de las praderas | Humanos | 2003, Estados Unidos | Capturados y en contacto con roedores de Ghana | Transmisión por contacto |
| Coronavirus del síndrome respiratorio agudo grave (SARS-CoV) | Murciélagos | CivetasHumanos | 2002-2003, China | Cría y comercio de civetasInteracción con murciélagos en los mercadosTransmisión interhumana | Transmisión aerógena>8000 casos(>30 países)Letalidad: 13-18% |
| Coronavirus del síndrome respiratorio de Oriente Medio (MERS-CoV) | Murciélagos | DromedariosHumanos | 2012, Arabia Saudí | Contacto con dromedariosTransmisión interhumana | >2000 casos (27 países)Letalidad: 30-42% |
Dichos modelos reflejan la realidad puntual de un proceso dinámico que evoluciona de forma diferente para cada agente patógeno. En este sentido, Wolfe et al.15 propusieron cinco fases adaptativas: 1) presencia del agente patógeno en el reservorio animal sin infección humana; 2) transmisión natural animal-humano sin transmisión interhumana (p. ej., la rabia); 3) mantenimiento del ciclo animal con transmisión interhumana ocasional (p. ej., el Ébola); 4) existencia de ciclo silvestre en animales con amplios brotes de transmisión secundaria interhumana sin la participación del reservorio animal (p. ej., el dengue); y 5) presencia de un patógeno exclusivamente humano (p. ej., el sida). Alternativamente a este modelo piramidal basado en las características del agente patógeno y su adaptación a la especie humana, Morse et al.12 propusieron un modelo de tres etapas basado en la dinámica de la infección y la frecuencia de los sucesos que ocurren desde la fase de preemergencia, con el agente en su medio natural, hasta la fase de emergencia pandémica, pasando por la fase intermedia de emergencia localizada con transmisión interhumana limitada.
Junto a la importancia del reservorio silvestre en la emergencia de una zoonosis, no se debe olvidar el papel del ganado en dicho proceso. Participa en el mantenimiento, la amplificación y la transmisión de zoonosis9,16 que no por conocidas dejan de tener riesgo de (re)emergencia. Así, entre los agentes patógenos identificados en la interfaz fauna silvestre-ganado se han relacionado el virus de la gripe, Brucella spp., Mycobacterium bovis,Coxiella burnetii,Bacillus anthracis, el virus de la fiebre hemorrágica de Crimea-Congo, el virus de la fiebre del Valle del Rift, el virus Wesselsbron y el Huaiyangshan banyangvirus.
De acuerdo con los antecedentes o la situación actual de los distintos virus, se han propuesto como candidatas a ocasionar próximas emergencias zoonóticas las familias Nairoviridae, Phenuiviridae, Coronaviridae, Arteriviridae, Flaviviridae, Orthomyxoviridae, Paramyxoviridae, Poxviridae y Herpesviridae17.
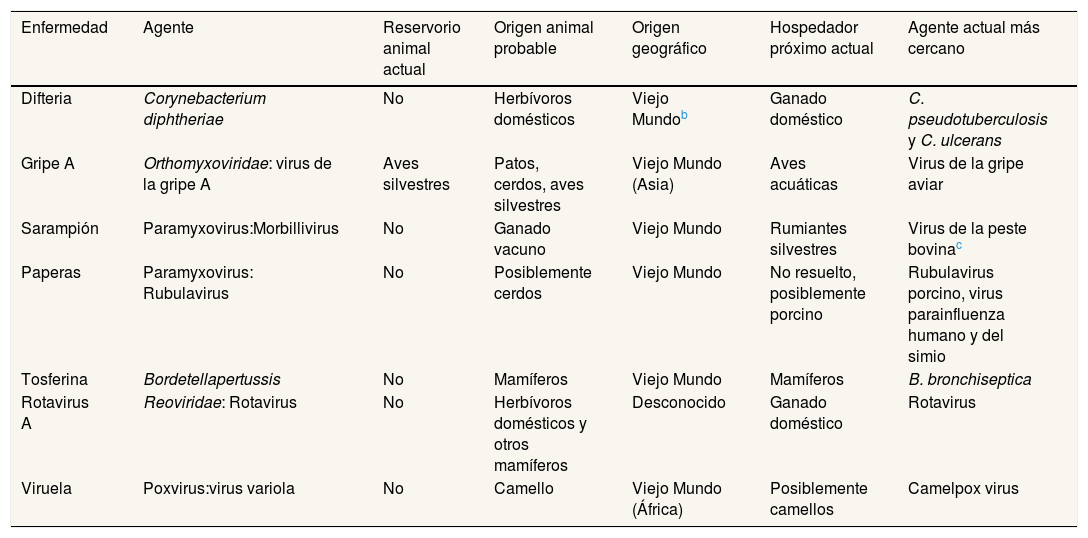
Origen zoonótico de las principales enfermedades humanasLos determinantes de origen antrópico que alcanzan una dimensión global no son exclusivos del Antropoceno. En este aspecto, es destacable el análisis planteado por Wolfe et al.15 sobre el origen animal de las principales enfermedades humanas. Las 25 enfermedades estudiadas fueron seleccionadas en función de la importancia histórica y evolutiva de su letalidad y morbilidad. Además, se dividieron según su origen en zonas templadas (n=15) o en regiones tropicales (n=10). En la tabla 3 se relacionan las siete enfermedades originadas en zonas templadas a partir de animales domésticos en las que en la actualidad no existe un reservorio animal y son exclusivamente humanas (con la excepción de los virus de la gripe). Además, entre las enfermedades originadas en las zonas templadas hay que añadir la hepatitis B, la peste bubónica y el tifus, cuyo origen se atribuye a animales silvestres o sinantrópicos, y la rubeola, la sífilis, el tétanos y la salmonelosis, en las que el origen animal se desconoce.
| Enfermedad | Agente | Reservorio animal actual | Origen animal probable | Origen geográfico | Hospedador próximo actual | Agente actual más cercano |
|---|---|---|---|---|---|---|
| Difteria | Corynebacterium diphtheriae | No | Herbívoros domésticos | Viejo Mundob | Ganado doméstico | C. pseudotuberculosis y C. ulcerans |
| Gripe A | Orthomyxoviridae: virus de la gripe A | Aves silvestres | Patos, cerdos, aves silvestres | Viejo Mundo (Asia) | Aves acuáticas | Virus de la gripe aviar |
| Sarampión | Paramyxovirus:Morbillivirus | No | Ganado vacuno | Viejo Mundo | Rumiantes silvestres | Virus de la peste bovinac |
| Paperas | Paramyxovirus: Rubulavirus | No | Posiblemente cerdos | Viejo Mundo | No resuelto, posiblemente porcino | Rubulavirus porcino, virus parainfluenza humano y del simio |
| Tosferina | Bordetellapertussis | No | Mamíferos | Viejo Mundo | Mamíferos | B. bronchiseptica |
| Rotavirus A | Reoviridae: Rotavirus | No | Herbívoros domésticos y otros mamíferos | Desconocido | Ganado doméstico | Rotavirus |
| Viruela | Poxvirus:virus variola | No | Camello | Viejo Mundo (África) | Posiblemente camellos | Camelpox virus |
Se ha excluido la tuberculosis de la relación inicial propuesta por Wolfe et al.15 Las deleciones presentes en el genoma de Mycobacterium bovis demuestran que su origen es posterior a las micobacterias adaptadas a la especie humana.
Entre las enfermedades tropicales estudiadas15, el patrón evolutivo presenta mayor variedad. Con la excepción del sida y la malaria por Plasmodium falciparum, que se consideran enfermedades exclusivamente humanas, el resto de las estudiadas presentan un reservorio animal relativamente cercano al origen animal propuesto. Al mismo tiempo, en seis de ellas se excluye el origen doméstico; así, el sida, el dengue, la malaria por Plasmodium vivax y la fiebre amarilla se originaron a partir de primates, el cólera de algas e invertebrados acuáticos, y la malaria por P. falciparum a partir de gorilas. La enfermedad de Chagas, la enfermedad del sueño de África Oriental y la enfermedad del sueño de África Occidental se atribuyen a mamíferos domésticos y silvestres, y la leishmaniasis visceral se relaciona en su origen con los perros y los roedores.
Entre las principales enfermedades infecciosas que afectan actualmente a la especie humana se encuentran algunas que podrían haber surgido en los últimos 11.000 años como consecuencia del desarrollo de la agricultura, la domesticación de las principales especies de interés ganadero, el incremento de las poblaciones humanas y de animales domésticos, y la interacción de ambos en un medio modificado. Los determinantes de la salud asociados a la evolución de las poblaciones humanas de cazadores-recolectores hacia sociedades agrícolas, y su impacto en la historia de la humanidad, fueron investigados por Diamond18 y se corresponden geográficamente y temporalmente con los planteamientos evolutivos propuestos por Wolfe et al.15 para las diferentes enfermedades.
Análisis de la COVID-19 bajo el prisma One HealthLa COVID-19ha supuesto, con la información disponible actualmente, un ejemplo más de virus emergente de carácter zoonótico procedente de los murciélagos que ha completado el salto a la especie humana5, desconociéndose por el momento el papel epidemiológico que puedan haber desempeñado otras especies animales. Diversos estudios, basados tanto en las características genómicas del SARS-CoV-2 y otros coronavirus animales19 como en la similitud del tipo de receptores asociados a la entrada del virus en las células infectadas20, han propuesto al pangolín como ese posible huésped intermediario en el proceso de adaptación del SARS-CoV-2 a la especie humana, de modo similar al desempeñado por la civeta en el caso de la infección por SARS-CoV-121, aunque este hecho aún no se ha demostrado.
La COVID-19 también ha evidenciado la necesidad de vigilar la presencia de otros huéspedes que puedan desempeñar un papel epidemiológico de interés en la difusión y el mantenimiento de la infección, quedando demostrada la receptibilidad de otras especies como mustélidos, felinos, carnívoros y roedores, tanto del ámbito doméstico como del silvestre, al coronavirus SARS-CoV-222–27. Por otra parte, también se ha demostrado que otras especies, como el ganado porcino26 y los rumiantes, no parecen ser receptivos a la infección, tal como ya preveían algunos estudios basados en la secuencia de los receptores ACE-220.
No obstante, la sensibilidad de las especies infectadas ha sido diversa y, en la mayor parte de los casos, no se considera que desempeñen un papel epidemiológico de interés para el mantenimiento y la transmisión de la infección. Así, observamos algunas especies, como los hurones y los visones, en las que la infección natural puede generar cuadros clínicos importantes e incluso mortalidad asociada a la presencia de neumonía intersticial25,28, y otras, como los perros, en que las infecciones naturales o experimentales realizadas hasta ahora han generado básicamente infecciones asintomáticas29. Desde el punto de vista experimental, la inoculación de una elevada carga viral en diversas especies no ha generado cuadros de mortalidad, sino una sintomatología leve, con la excreción parcial de virus principalmente por vía respiratoria durante unos pocos días. En este sentido, parecen haber sido los mustélidos, y en particular los visones, una de las especies más afectadas por la infección28.
Cabe señalar, como uno de los principales aciertos en relación con la pandemia, el conocimiento adquirido sobre el papel de las diferentes especies en la epidemiología del SARS-CoV-2, lo que ha permitido tomar decisiones en relación con las mascotas y los animales de producción. Asumiendo que la infección en la mayor parte de las especies animales analizadas hasta ahora es ocasional, la transmisión interespecie se ha documentado de modo natural y experimental en los gatos y los visones24,28; sin embargo, solo se ha demostrado el salto posterior de la especie infectada a la humana en los visones30. Este hecho ha determinado el sacrificio de millones de individuos; además, se ha confirmado la aparición de nuevas variantes del virus durante la circulación en las granjas de visones31.
Vigilancia y estrategias de prevención de futuras pandemiasEl programa PREDICT es una de las principales experiencias previas de vigilancia de amenazas pandémicas desarrollada globalmente. En dicho programa, financiado por la United States Agency for International Development (USAID), se trabajó con más de 60 países en el periodo 2009-2019 y se identificaron al menos 931 especies de virus nuevos a partir de 145.000 muestras de fauna silvestre, ganado y humanos32.
A pesar del éxito del programa, es evidente que el descubrimiento de nuevos virus no evita futuras pandemias, por lo que es necesario compatibilizar los esfuerzos en aspectos básicos de virología y ecología con aquellos orientados a la vigilancia, el diagnóstico y la atención primaria. Al mismo tiempo, se ha propuesto que la próxima generación de herramientas de evaluación de riesgos zoonóticos debe integrar aspectos como la secuenciación genómica y metagenómica, y la relación entre vectores y hospedadores con la interacción de las estructuras virales con los receptores del hospedador33.
En la práctica, la integración de las estrategias de bioseguridad en los esquemas de conservación de la biodiversidad debe contemplar también los aspectos sociales implicados (tabla 4), principalmente en los países en vías de desarrollo donde la población rural depende de los recursos naturales existentes en zonas calificadas como hotspots para la emergencia de zoonosis13. Junto a las particularidades de los pueblos indígenas y las comunidades locales, tanto las medidas de intervención como las de vigilancia deben incorporar una visión de género que garantice que las mujeres estén representadas en la toma de decisiones y en la elaboración de procesos7. El 43% de la fuerza laboral en el sector agrícola de los países en desarrollo está compuesto por mujeres, al tiempo que desarrollan un trabajo no remunerado fundamental para el crecimiento económico, la salud y el bienestar de sus familias y comunidades. En este contexto, habida cuenta del papel de la mujer en las actividades de cuidado del ganado, el manejo y la preparación de alimentos, los cultivos, el acceso a los recursos naturales, etc., es un hecho asumido que el rol de género modifica tanto la exposición como el impacto de las enfermedades infecciosas. Por todo ello, se han propuesto análisis desagregados por sexo para el desarrollo de las estrategias One Health34 (tabla 5) que han permitido adaptar los programas de promoción de la salud para mitigar los riesgos específicos de cada sexo en las comunidades rurales35.
Resumen de las respuestas para aplicar medidas de bioseguridad y conservación en las regiones afectadas por situaciones de riesgo sanitario13
| Categoría | Problema | Respuesta propuesta |
|---|---|---|
| Explotación de la fauna silvestre | Comercio ilegalConsumo de carne | Prohibición de las vías legales existentes para el comercio y consumo de fauna silvestreAumentar los esfuerzos para evitar el comercio ilegalNo criminalizar a la fauna silvestre y educación para evitar su uso inapropiado |
| Disfunción humano-ambiente | Destrucción ambiental e invasión de las fronteras forestalesExpansión de actividades económicas con cambios demográficos | Reconocer los vínculos entre la salud humana y ambientalMejorar la conservación mediante áreas protegidasIncrementar la vigilancia sanitaria en el comercio de fauna silvestre y la interfaz con el ser humano |
| Alteración pandémica | Pérdidas económicas que conducen a las comunidades a depender de actividades ilegales destructivas del medioDisminución del flujo económico en las áreas protegidas (p. ej., turismo) | Diversificar el modelo productivo, más allá del turismo, hacia relaciones más sostenibles con los países desarrolladosPrevenir futuras pandemias mediante un mayor control del comercio ilegal de fauna silvestre |
Elementos para integrar la perspectiva de género en la estrategia One Health34
| Elemento | Componentes |
|---|---|
| Análisis de género | Definición de los roles de género en cada comunidadEvaluación de la discriminación de géneroPromoción de la igualdad de género y equidadEvaluación del impacto de las zoonosis y enfermedades transmitidas por vectores en función del género |
| Empoderamiento de las mujeres en la agricultura | Acceso a recursos productivosDerechos sobre la tierraServicios integralesLiderazgo y acción colectivaAcceso al mercado y a la cadena de valorEducación, formación e información |
| Estrategias educativas | Programas de tutoría y liderazgo de ámbito local, regional y nacionalMateriales de aprendizaje visuales, multilingües y de bajo nivel de alfabetizaciónFinanciación y contratación equitativa de mujeres como formadorasFormar a instructores sobre cómo evitar el sesgo de géneroEntornos de aprendizaje seguros, sensibles al género, culturalmente apropiados e inclusivosServicios integrales, como guardería y transporte, para asegurar la participación de alumnado y formadores |
La experiencia ha demostrado que los esfuerzos locales de vigilancia se ven superados por los fenómenos de emergencia de zoonosis. Ante dicha realidad, la Organización Mundial de la Salud (OMS), la Organización Mundial de la Sanidad Animal (OIE) y la Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO) han trabajado conjuntamente en el desarrollo de las estrategias One Health (tabla 1). Además, con el objetivo de proporcionar mandatos claros en la prevención de pandemias, se ha propuesto la creación de un consejo intergubernamental de alto nivel que pueda desarrollar competencias para alertar a los gobiernos, al sector privado y a la sociedad civil sobre los riesgos de posibles pandemias. Entre los mecanismos de acción política que fomenten cambios hacia la prevención de pandemias se han propuesto los siguientes7:
- •
Promocionar la investigación sobre los determinantes asociados a la aparición de pandemias, predecir áreas de alto riesgo y evaluar el impacto económico de posibles pandemias, así como coordinar el seguimiento de los objetivos acordados entre los países.
- •
Políticas para reducir el impacto del cambio en el uso del suelo: evaluación de riesgos, ayudas económicas que contemplen la reducción del riesgo sanitario y la protección de la biodiversidad, restauración ambiental y fomento de la modificación de las formas de consumo basadas en la agricultura y la ganadería globalizadas.
- •
Políticas para reducir los riesgos asociados al comercio de fauna silvestre: coordinación intergubernamental, educación en las comunidades, reducción o eliminación del comercio de las especies de alto riesgo, bioseguridad de mercados, vigilancia sanitaria en los colectivos implicados (cazadores, agricultores, comerciantes, etc.) y mejorar la colaboración contra el comercio ilegal.
- •
Fomentar la participación de todos los sectores de la sociedad: educación de nuevas generaciones, identificación de patrones de consumo de riesgo y promoción del consumo responsable de productos de origen animal, aplicación de impuestos/incentivos de sostenibilidad para la producción agropecuaria y el consumo en función del riesgo asociado de enfermedades zoonóticas.
La pandemia de COVID-19ha hecho evidente la importancia de la interacción de los humanos con el resto de los animales y los ecosistemas. Habida cuenta de que los principales determinantes de emergencia de zoonosis son de origen antrópico, se impone la necesidad de incorporar una visión sanitaria multidisciplinaria a la toma de decisiones de alcance global. En este sentido, el conocimiento de la evolución natural de las zoonosis permite identificar los puntos críticos para su control, al tiempo que posibilita identificar posibles agentes candidatos a ocasionar futuras pandemias. De forma específica, los avances en el conocimiento de los posibles reservorios animales del SARS-CoV-2 han contribuido a la toma de decisiones durante la pandemia. Por todo ello, y ante la variedad de escenarios que posibilitan el salto de especie y la evolución de los diferentes patógenos en los distintos hospedadores, la vigilancia frente a la emergencia de zoonosis debe basarse en la estrategia One Health, planteándose la necesidad de coordinar estructuras supranacionales que respondan de forma dinámica a dichas necesidades.
Contribuciones de autoríaA. Sánchez y C. de la Fe escribieron un primer borrador del manuscrito. Todas las personas firmantes revisaron el manuscrito, realizaron aportaciones y aprobaron su versión final.
FinanciaciónNinguna.
Conflictos de interesesNinguno.