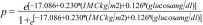Desarrollar y validar internamente un modelo matemático para estimar la resistencia a la insulina (RI) mediante dos variables: el índice de masa corporal (IMC) y la glucosa en ayunas. Este modelo se denomina «índice IMC y glucosa».
MétodoEstudio transversal en población mexicana. Se evaluaron 112 participantes mediante métodos estandarizados de muestras de sangre y mediciones antropométricas. Se obtuvo un modelo matemático mediante regresión logística binomial, se validó internamente y se determinó su utilidad clínica.
ResultadosEl índice IMC y glucosa obtuvo un AUC de 0,872 (IC95%: 0,807-0,936; p <0,001) y un punto de corte de 0,30, con una sensibilidad del 93% y una especificidad del 69%.
ConclusionesNuestros resultados muestran una buena capacidad diagnóstica preliminar, que debe confirmarse en estudios poblacionales mayores y longitudinales para su posible aplicación en atención primaria como método de tamizaje para detectar RI.
.
To develop and internally validate a mathematical model to estimate insulin resistance (IR) using two variables: body mass index (BMI) and fasting glucose. This model is called “BMI-glucose index”.
MethodCross-sectional study in a Mexican population. 112 participants were evaluated using standardized blood sampling methods and anthropometric measurements. A mathematical model was obtained using binomial logistic regression, internally validated, and its clinical utility was determined.
ResultsThe BMI-glucose index had an AUC of 0.872 (95%CI: 0.807-0.936; p <0.001) and a cutoff point of 0.30, with a sensitivity of 93% and a specificity of 69%.
ConclusionsOur results show good preliminary diagnostic capacity, which should be confirmed in larger, longitudinal population studies for its possible application in primary healthcare as a screening method to detect individuals with IR.
La resistencia a la insulina (RI) es una condición en la que existe una disminución en la respuesta metabólica de las células de los tejidos periféricos a la insulina1. Actualmente se utilizan distintos indicadores indirectos para medir la RI, y el parámetro más utilizado es la Evaluación del Modelo Homeostático de Resistencia a la Insulina (HOMA-IR)2. Se ha reportado que la RI se asocia con un mayor riesgo de diabetes, hipertensión y eventos cardiovasculares adversos3,4. Por ello, sería importante medirla de forma preventiva en atención primaria considerando la alta prevalencia en la población5.
Previamente se han validado índices para la RI en población mexicana, y se encontró que la mayoría de ellos alcanzaron una precisión moderada (área bajo la curva [AUC]: 0,70-0,80). El TyG*IMC obtuvo el mayor poder discriminatorio6,7, pero requiere la medición de dos variables bioquímicas además del índice de masa corporal (IMC), lo que podría complicar su aplicación en atención primaria. La glucosa en ayunas y el IMC han demostrado ser buenos predictores de morbilidad y mortalidad en diversas enfermedades metabólicas8,9. Por lo anterior, el objetivo de este trabajo es desarrollar y validar internamente un nuevo modelo, el «índice IMC y glucosa», para estimar la RI mediante dos variables: el IMC y la glucosa en ayunas.
MétodoParticipantesSe reclutaron 112 participantes de entre 18 y 70 años mediante un muestreo no probabilístico por invitación pública en la ciudad de Santiago de Querétaro, México. Se excluyeron las personas con diagnóstico previo de diabetes mellitus tipo 2, con valores de hemoglobina glucosilada (HbA1c) ≥ 6,5% o con glucosa en ayunas ≥ 126mg/dl, y las mujeres embarazadas o en periodo de lactancia. Se formaron dos grupos: sanos y con resistencia a la insulina. Para el diagnóstico de RI se consideró el punto de corte del índice HOMA-IR ≥ 2,4, que representa el percentil 90 de la población mexicana10.
Todos los participantes firmaron su consentimiento informado. El estudio fue aprobado por el Comité de Investigación y Bioética del Hospital General de Querétaro (397/20-09-2022).
Determinación de las variables séricasSe tomó una muestra de sangre después de un ayuno de 12 horas. El suero se separó por centrifugación a 1500×g durante 15 minutos a 4°C. Los parámetros bioquímicos séricos, incluyendo las concentraciones de glucosa plasmática en ayunas, el colesterol unido a lipoproteínas de alta densidad, el colesterol total y los triglicéridos, se midieron por métodos enzimáticos siguiendo las especificaciones del fabricante (Spinreact S.A./S.A.U., Girona, España: SPIN 200E); la insulina se determinó por electroquimioluminiscencia (Cobas e 602: 12017547214) y la HbA1c con cromatografía líquida de alta resolución (Variant II Turbo, BIORAD).
AntropometríaLa antropometría se determinó con los procedimientos recomendados por la Organización Mundial de la Salud11. La estatura se midió con un estadímetro (SECA, modelo 206), el peso corporal se estableció en kilogramos y el porcentaje de grasa corporal y la grasa visceral se midieron por bioimpedancia eléctrica en una báscula electrónica (JAWON MEDICAL, modelo ioi353).
Análisis estadísticoEl análisis estadístico se realizó únicamente con los casos completos mediante el programa SPSS V. 30 para Windows. Las variables se describen por grupos con mediana y rango intercuartílico, y en frecuencias con porcentaje. La comparación de las variables se realizó con la prueba U de Mann-Whitney.
Se realizó un modelo de regresión logística binaria con validación interna, y se evaluaron la calibración y la utilidad clínica. Se realizaron el análisis de supuestos del modelo y el análisis de potencia post-hoc para el tamaño de la muestra. Por último, se hizo un análisis comparativo entre la capacidad diagnóstica del índice IMC y glucosa y de los modelos validados previamente. Las pruebas se realizaron con un nivel de significancia de p ˂0,05.
ResultadosCaracterísticas clínicasSe incluyeron 112 participantes (64 mujeres y 48 hombres). Con el punto de corte para RI de HOMA-IR ≥ 2,4 se obtuvo una prevalencia del 48,2% en los participantes. En la tabla 1 se detallan las características clínicas de los sujetos.
Características clínicas de los participantes, por grupo
| Variable | Sanos (n=58) | Con resistencia a la insulina (n=54) |
|---|---|---|
| Mujeres, n (%) | 34 (59) | 30 (56) |
| Hombres, n (%) | 24 (41) | 24 (44) |
| Edad, años | 30,5 (23,7-46,3) | 42,0 (26,0-54,0)a |
| 18-44 años, n (%) | 43 (74) | 31 (57) |
| 45-70 años, n (%) | 15 (26) | 23 (43) |
| IMC, kg/m2 | 24,1 (21,2-26,8) | 29,2 (26,1-33,2)b |
| Normal, n (%) | 33 (57) | 8 (15) |
| Sobrepeso, n (%) | 21 (36) | 22 (41) |
| Obesidad, n (%) | 4 (7) | 24 (44) |
| Grasa corporal (%) | 28,5 (22,8-34,5) | 36,2 (30,2-39,4)b |
| Grasa visceral (%) | 10,0 (6,8-12,0) | 14,0 (11,0-17,0)b |
| Glucosa en ayunas (mg/dl) | 80,0 (73,8-87,2) | 92,5 (85,8-99,0)b |
| HbA1c (%) | 5,5 (5,2-5,7) | 5,7 (5,5-6,0)c |
| Insulina (uIU /ml) | 7,9 (6,4-9,7) | 16,1 (13,3-19,9)b |
| Índice HOMA-IR | 1,54 (1,2-1,9) | 3,7 (3,0-4,7)b |
| Colesterol total (mg/dl) | 167,0 (147,8-181,3) | 179,0 (153,0-197,5) |
| Colesterol HDL (mg/dl) | 48,0 (41,0-58,3) | 40,0 (33,5-49,0)b |
| Triglicéridos (mg/dl) | 85,5 (68,5-122,5) | 117,0 (89,8-195,0)b |
HbA1c: hemoglobina glucosilada; HDL: lipoproteínas de alta densidad; IMC: índice de masa corporal.
Los datos se expresan como mediana y rango intercuartílico. Análisis estadístico mediante prueba U de Mann Whitney.
La regresión logística binaria con remuestreo bootstrap indica que el IMC y la glucosa son predictores significativos de la RI (X2=55,90; gl=2; p=<0,001). Los dos predictores explican el 52,4% de la variabilidad de la RI (R2Nagelkerke=0,524). La odds ratio (OR) para el IMC es de 1,26 (intervalo de confianza del 95% [IC95%]: 1,12-1,42) y para la glucosa es de 1,13 (IC95%: 1,10-1,10). El modelo arroja valores entre 0,1 y 1,0 para predecir la RI.
El modelo matemático del índice IMC y glucosa es el siguiente:
Este índice muestra una buena calibración a través del intercepto (0,000), la pendiente (1,00) y el índice Brier (0,145). Además, cumple con los supuestos de independencia (Durbin-Watson=2,215) y de no colinealidad (VIF=1,082). Se realizó el análisis de potencia post-hoc de la muestra con la R2 obtenida del modelo y se obtuvo una potencia del 100% (1 – β=1,0; p=0,001). Por último, se ajustó el modelo por sexo (OR: 1,46; IC95%: 0,53-4,05; p=0,465) y edad (OR: 0,98; IC95%: 0,94-1,01; p=0,207), sin que estas variables resultaran significativas.
Determinación de la utilidad clínica del índice IMC y glucosaCon los mismos datos de los participantes se realizó una curva ROC (Receiver Operating Characteristic) para determinar la utilidad clínica del modelo, tomando como estándar los resultados por el índice HOMA-IR. El AUC del modelo fue de 0,872 (IC95%: 0,807-0,936; p <0,001), y con un punto de corte de 0,30 calculado por el índice de Youden, el modelo predijo correctamente el 93% (sensibilidad) de los casos en los que sí había RI y el 69% (especificidad) de los casos en los que no había RI (fig. 1 A), con un valor predictivo positivo de 0,74 y un valor predictivo negativo de 0,91.
Determinación de la utilidad clínica del índice IMC y glucosa. A: curva ROC del índice IMC y glucosa. B: análisis comparativo de la curva ROC del índice IMC y glucosa con la glucosa en ayunas y el índice de masa corporal (IMC) por separado, y con otros índices establecidos para RI: índice de triglicéridos y colesterol de lipoproteínas de alta densidad (HDL); índice metabólico de resistencia a la insulina (índice METS-IR); índice de triglicéridos y glucosa, e índice de triglicéridos y glucosa * IMC. C: curva de precisión/exhaustividad para la comparación del índice IMC y glucosa con la glucosa en ayunas y el IMC por separado, y con los índices establecidos para RI. AUC: área bajo la curva; IC95%: intervalo de confianza del 95%.
También se realizó un análisis comparativo del índice IMC y glucosa con otros índices predictivos de RI establecidos (fig. 1 B y C).
DiscusiónEn este estudio se desarrolló y validó internamente el índice IMC y glucosa para la predicción de RI, con el fin de evaluar su utilidad clínica como un nuevo método de tamizaje en atención primaria.
Se comparó la utilidad clínica del índice IMC y glucosa con diferentes índices establecidos para estimar la RI6,12, así como con solo la glucosa en ayunas y el IMC por separado, y se encontró que mostró una mejor utilidad clínica sobre los otros índices evaluados. El índice que se acercó más al nuestro fue el METS-IR, con un AUC de 0,827 (IC95%: 0,746-0,907; p <0,001), pero este utiliza cuatro variables para su medición, lo que podría limitar su uso13.
El índice IMC y glucosa muestra una buena capacidad diagnóstica preliminar; sin embargo, el estudio presenta algunas limitantes, como el tipo de muestreo, la falta de validación externa del modelo y que, al tratarse de un estudio transversal, no se pueden establecer relaciones causales entre las variables analizadas. Por lo tanto, se necesitan estudios adicionales en poblacionales mayores y longitudinales para su posible aplicación en atención primaria en distintas poblaciones.
Disponibilidad de bases de datos y material para réplicaLos datos que respaldan las conclusiones de este estudio están disponibles previa solicitud a los autores y con la autorización del Comité de Bioética del Hospital General de Querétaro.
El parámetro más utilizado para medir la resistencia a la insulina (RI) es la Evaluación del Modelo Homeostático de RI (HOMA-IR). La RI se asocia con un mayor riesgo de diabetes, hipertensión y eventos cardiovasculares adversos, por lo que es importante su medición de forma preventiva.
¿Qué añade el estudio realizado a la literatura?Se desarrolla y valida internamente el índice de IMC y glucosa para estimar la RI mediante la determinación de la glucosa en ayunas y el índice de masa corporal (IMC), el cual presenta una buena utilidad clínica.
¿Cuáles son las implicaciones de los resultados obtenidos?El índice IMC y glucosa podría ser útil para el tamizaje de la RI en atención primaria, como una opción más accesible y alternativa a los métodos ya existentes.
Alberto Lana.
Declaración de transparenciaEl autor principal (garante responsable del manuscrito) afirma que este manuscrito es un reporte honesto, preciso y transparente del estudio que se remite a Gaceta Sanitaria, que no se han omitido aspectos importantes del estudio, y que las discrepancias del estudio según lo previsto (y, si son relevantes, registradas) se han explicado.
Contribuciones de autoríaConceptualización: M.G. López-Velázquez, N. Camacho-Calderón y C. Campos-Ramírez. Recolección de datos: M.G. López-Velázquez, J.A. Torres-Juárez, M.R. Moreno-Ramírez, A.G. Díaz-Martel, D.S. Díaz-Ortegón y S. Mondragón-Rodríguez. Análisis e interpretación de datos: M.G. López-Velázquez, N. Camacho-Calderón, J.A. Torres-Juárez, M.R. Moreno-Ramírez, A.G. Díaz-Martel, D.S. Díaz-Ortegón, S. Mondragón-Rodríguez y C. Campos-Ramírez. Redacción del borrador original: M.G. López-Velázquez, N. Camacho-Calderón y C. Campos-Ramírez. Redacción, revisión y edición: M.G. López-Velázquez, N. Camacho-Calderón, J.A. Torres-Juárez, M.R. Moreno-Ramírez, A.G. Díaz-Martel, D.S. Díaz-Ortegón, S. Mondragón-Rodríguez y C. Campos-Ramírez. Supervisión: N. Camacho-Calderón y C. Campos-Ramírez. Adquisición de financiamiento: N. Camacho-Calderón y C. Campos-Ramírez.
AgradecimientosA la Unidad Policlínica de Atención Primaria y a la Unidad de Servicios Clínicos y Moleculares de la Universidad Autónoma de Querétaro, por su apoyo en la realización del presente estudio.
FinanciaciónLa presente investigación estuvo financiada por el FONDEC-UAQ 2022 (FME202301).
Conflictos de interesesNinguno.